Радикалы свободные, кинетически независимые частицы, характеризующиеся наличием неспаренных электронов. Например, к неорганическим Р. с., имеющим на внешнем уровне один электрон (см. Атом, Валентность), относятся атомы водорода Н·, щелочных металлов (Na·, К· и др.) и галогенов (Cl, Br, F, I), молекулы окиси ·NO и двуокиси NO2 азота (точка означает неспаренный электрон). Наиболее широко распространены Р. с. в органической химии. Их подразделяют на короткоживущие и долгоживущие. Короткоживущие алкильные (R) и арильные (Ar) Р. с. со временем жизни менее 0,1 сек образуются при гомолитическом расщеплении различных химических связей. Впервые алкильные Р. с. метил ( Н3) и этил (СН3
Н3) и этил (СН3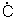 Н2) были обнаружены (1929) Ф. Панетом при термическом разложении тетраметил- и тетраэтилсвинца в газовой фазе. Для короткоживущих Р. с. характерны реакции рекомбинации (а), присоединения (б) и диспропорционирования (в), протекающие с очень высокими скоростями:
Н2) были обнаружены (1929) Ф. Панетом при термическом разложении тетраметил- и тетраэтилсвинца в газовой фазе. Для короткоживущих Р. с. характерны реакции рекомбинации (а), присоединения (б) и диспропорционирования (в), протекающие с очень высокими скоростями:
CH3CH2 H2 + CH3CH2
H2 + CH3CH2 H2 = CH3(CH2)4CH3 (а)
H2 = CH3(CH2)4CH3 (а)
CH3CH2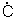 H2 + R = CH3CH2CH2
H2 + R = CH3CH2CH2 (б)
(б)
CH3CH2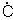 H2 + CH3CH2
H2 + CH3CH2 H2 == CH3CH2CH3 + CH3CH=CH2 (в)
H2 == CH3CH2CH3 + CH3CH=CH2 (в)
С. Хиншелвуд и Н. Н. Семенов показали важную роль короткоживущих Р. с. в цепных реакциях, механизм которых включает перечисленные выше типы реакций.
Значительное число Р. с. принадлежит к долгоживущим, или стабильным. В зависимости от условий (например, наличие или отсутствие влаги и кислорода воздуха) продолжительность жизни их составляет от нескольких минут до нескольких месяцев и даже лет. Более высокая устойчивость этих Р. с. обусловлена следующими основными причинами: 1) частичной потерей активности неспаренного электрона в результате взаимодействия его со многими атомами молекулы (т. н. делокализация неспаренного электрона); 2) малой доступностью атома, несущего неспаренный электрон, вследствие экранирования его соседними атомами (см. Пространственные затруднения).
Первый стабильный Р. с. — трифенил-метил (С6Н5)3 был получен (1900) американским химиком М. Гомбергом при действии серебра на трифенилбромметан. Устойчивость этого радикала связана с делокализацией неспаренного электрона по всем атомам, что формально можно объяснить резонансом между возможными электронными структурами (см. Резонанса теория, Квантовая химия):
был получен (1900) американским химиком М. Гомбергом при действии серебра на трифенилбромметан. Устойчивость этого радикала связана с делокализацией неспаренного электрона по всем атомам, что формально можно объяснить резонансом между возможными электронными структурами (см. Резонанса теория, Квантовая химия):

Известно большое число триарилметильных Р. с. К Р. с., стабильным благодаря пространственным явлениям, относятся продукты окисления замещенных фенолов, т. н. феноксильные Р. с., например три-трет-бутилфеноксил (1). Др. примеры долгоживущих Р. с. — дифенилпикрилгидразил (II), а также иминоксильные Р. с., апреля тетраметилпиперидиноксил (III) и бис-трифторметилнитроксил (IV):

При окислении или восстановлении нейтральных молекул образуются заряженные Р. с. — катион-радикалы (например, при окислении ароматических углеводородов кислородом) или анион-радикалы (при восстановлении ароматических углеводородов щелочными металлами):

Самостоятельную группу анион-радикалов представляют открытые (1932) нем. химиком Л. Михаэлисом продукты одноэлектронного восстановления хинонов — семихиноны, например бензосемихинон:

Р. с., содержащие два не взаимодействующих друг с другом неспаренных электрона, называют бирадикалами; примером может служить углеводород Шлёнка:

К неорганическим бирадикалам относится молекула кислорода. Существуют также полирадикалы, содержащие более двух неспаренных электронов.
Р. с. исследуются различными физико-химическими методами (электронная спектроскопия, масс-спектроскопия, электрохимические методы, метод ядерного магнитного резонанса). Наиболее эффективен метод электронного парамагнитного резонанса (ЭПР), которым можно исследовать и короткоживущие Р. с. ЭПР даёт уникальную информацию о физической природе неспаренного электрона и характере его поведения в молекуле; эти данные весьма ценны для квантовохимических расчётов.
Короткоживущие Р. с. — промежуточные частицы во многих органических реакциях (радикальное галогенирование, сульфо-хлорирование, металлирование, реакции Виттига, Кольбе, Коновалова, разложение органических перекисей и др.), а также в реакциях, протекающих под действием ионизирующих излучений. Долгоживущие Р. с. используются как стабилизаторы для легко окисляющихся соединений, как «ловушки» для короткоживущих радикалов, а также в ряде кинетических исследований. Изучение катион-радикалов и анион-радикалов даёт ценную информацию о характере взаимодействия ионов в растворе. Р. с. играют большую роль в окислительно-восстановительных, фотохимических и каталитических процессах, а также в важнейших промышленных процессах: полимеризации, теломеризации, пиролиза, крекинга, горения, взрыва, гетерогенного катализа.
Лит.: Уоллинг Ч., Свободные радикалы в растворе, пер. с англ., М., 1960; Семёнов Н. Н., О некоторых проблемах химической кинетики и реакционной способности, 2 изд., М., 1958; Бучаченко А. Л., Вассерман А. М., Стабильные радикалы. Электронное строение, реакционная способность и применение, М., 1973.
Н. Т. Иоффе.
В биологических системах многие биохимические реакции протекают с участием Р. с. в качестве активных промежуточных продуктов. Методом ЭПР показано, что все активно метаболизирующие клетки растений и животных содержат Р. с. в концентрации 10-6—10-8 молей на 1 г ткани. Особенно значительна роль Р. с. в реакциях окисления биологического, где они участвуют в образовании переносчиков электронов типа хинонов и флавинов, входящих в мембранные структуры. Р. с. возникают также при перекисном окислении липидов в биологических мембранах.
В организме Р. с. могут генерироваться и при действии на него различных физических и химических факторов. В частности, влияние радиации на организмы связывают с образованием Р. с. как при радиолизе воды, содержащейся в клетках (радикалы ·ОН, HO·2), так и при воздействии излучений на молекулы органических веществ и биополимеров клетки (см. Биологическое действие ионизирующих излучений, Кислородный эффект). Иминоксильные Р. с. широко применяют в биохимических исследованиях для выяснения конфигурации белковых молекул (метод спиновой метки и метод парамагнитного зонда) и функциональных свойств биологических мембран.
Лит.: Козлов Ю. П., Свободнорадикальные процессы в биологических системах, в книга: Биофизика, М., 1968; Ингрэм Д., Электронный парамагнитный резонанс в биологии, пер. с англ., М., 1972.
Ю. П. Козлов.
 Н3) и этил (СН3
Н3) и этил (СН3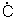 Н2) были обнаружены (1929) Ф. Панетом при термическом разложении тетраметил- и тетраэтилсвинца в газовой фазе. Для короткоживущих Р. с. характерны реакции рекомбинации (а), присоединения (б) и диспропорционирования (в), протекающие с очень высокими скоростями:
Н2) были обнаружены (1929) Ф. Панетом при термическом разложении тетраметил- и тетраэтилсвинца в газовой фазе. Для короткоживущих Р. с. характерны реакции рекомбинации (а), присоединения (б) и диспропорционирования (в), протекающие с очень высокими скоростями: H2 + CH3CH2
H2 + CH3CH2 H2 = CH3(CH2)4CH3 (а)
H2 = CH3(CH2)4CH3 (а)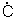 H2 + R = CH3CH2CH2
H2 + R = CH3CH2CH2 (б)
(б)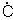 H2 + CH3CH2
H2 + CH3CH2 H2 == CH3CH2CH3 + CH3CH=CH2 (в)
H2 == CH3CH2CH3 + CH3CH=CH2 (в) был получен (1900) американским химиком М. Гомбергом при действии серебра на трифенилбромметан. Устойчивость этого радикала связана с делокализацией неспаренного электрона по всем атомам, что формально можно объяснить резонансом между возможными электронными структурами (см.
был получен (1900) американским химиком М. Гомбергом при действии серебра на трифенилбромметан. Устойчивость этого радикала связана с делокализацией неспаренного электрона по всем атомам, что формально можно объяснить резонансом между возможными электронными структурами (см. 



