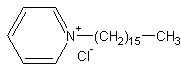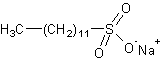Поверхностно-активные вещества — различия между версиями
VEK (обсуждение | вклад) |
Evgen (обсуждение | вклад) |
||
| (не показано 5 промежуточных версии 3 участников) | |||
| Строка 1: | Строка 1: | ||
'''Поверхностно-активные вещества (ПАВ)'''- вещества, добавление которых к жидкости снижает её [[поверхностное натяжение]]. | '''Поверхностно-активные вещества (ПАВ)'''- вещества, добавление которых к жидкости снижает её [[поверхностное натяжение]]. | ||
| − | Снижение поверхностного натяжения происходит за счёт адсорбции молекул ПАВ на границе двух сред жидкость-жидкость(вода/эфир) или жидкость-газ(спирт/воздух). Адсорбция ПАВ происходит самопроизвольно, | + | Снижение поверхностного натяжения происходит за счёт [[адсорбция|адсорбции]] молекул ПАВ на границе двух сред жидкость-жидкость(вода/[[диэтиловый эфир|эфир]]) или жидкость-газ([[спирт]]/[[воздух]]). Адсорбция ПАВ происходит самопроизвольно, то есть изменение энергии [[Гиббс]]а для этого процесса отрицательно (dG<0). Из этого следует, что взаимодействие между молекулами [[ПАВ]] и молекулами растворителя слабее, чем взаимодействие последних между собой, т.е. ПАВ как бы выталкивается из раствора на поверхность раздела. |
| − | + | ||
| − | + | ||
| − | + | ||
| + | Характерной особенностью строения ПАВ является их '''дифильность''', т.е. сродство одной части молекулы к полярным, а другой к неполярным средам. Классический пример - натриевые или калиевые соли высших жирных кислот, где длинный углеводородный [[радикал]] имеет сродство к жирам, а карбоксильная группа- к воде. (т.к. сами эти кислоты очень плохо растворимы в воде, то используются Na- и K- соли, растворимость которых выше) | ||
== Классификация ПАВ == | == Классификация ПАВ == | ||
| − | Различают | + | Различают '''[[катион]]огенные, [[анион]]огенные, и неионогенные''' ПАВ. В первых двух случаях молекулы ПАВ [[электролитическая диссоциация|диссоциируют]] в растворе на ионы. Адсорбируются на границе раздела фаз, соответственно, у анионогенных ПАВ (пример- мыла, R-COONa, адсорбируются R-COO<sup>-</sup>), анионы, у катионогенных- катионы (пример- хлорид цетилпиридиния Py-(CH<sub>2</sub>)<sub>16</sub>-CH<sub>3</sub>*HCl, адсорбируется Py<sup>(+)</sup>-(CH<sub>2</sub>)<sub>16</sub>-CH<sub>3</sub>). Неионогенные ПАВ- недиссоциирующие молекулы, чаще всего это продукт взаимодействия высшего спирта с несколькими молекулами [[этиленоксид]]а. В такой молекуле неполярным «хвостом» является углеводородный радикал, а полярным- этокси-олигомер. |
| − | + | * Олеат натрия [[Изображение:олеат_натрия.gif|middle]] | |
| − | *Олеат натрия | + | * Хлорид цетилпиридиния[[Изображение:цетилпиридиния_хлорид.gif|middle]] |
| − | [[Изображение:олеат_натрия.gif]] | + | * Схема синтеза неионогенного ПАВ |
| − | + | ||
| − | *Хлорид цетилпиридиния | + | |
| − | [[Изображение:цетилпиридиния_хлорид.gif]] | + | |
| − | + | ||
| − | *Схема синтеза неионогенного ПАВ | + | |
[[Изображение:синтез_Н-ПАВ.gif]] | [[Изображение:синтез_Н-ПАВ.gif]] | ||
| + | Существенным преимуществом неионогенных ПАВ является то, что легко можно регулировать их гидрофильность, вводя определённое число этоксигрупп. Кроме того, они не образуют соли и могут применяться для мытья в '''[[жёсткость воды|жёсткой воде]]''', а также можно использовать их сочетания с ионогенными ПАВ (если же смешать растворы анионогенного и катионогенного ПАВ, они нейтрализуют друг друга и дают соль, обычно очень труднорастворимую). | ||
| − | + | В настоящее время одной из серьёзных [[Экология|экологических]] проблем является загрязнение водных ресурсов синтетическими моющими веществами (мылами). Основным компонентов синтетических мыл являются алкилсульфокислоты или алкиларилсульфокислоты (можно встретить также названия алкилсульфонаты, алкил[[сульфоновые кислоты]]). Их достоинства — высокая моющая способность даже в очень жёсткой воде (в которой [[натуральные мыла]] выпадают в осадок) и в кислой среде (где натуральные мыла превращаются из натриевых солей в кислоты, нерастворимые в воде). Однако они не разлагаются, либо очень медленно разлагаются в естественных условиях, и соответственно накапливаются в водоёмах и Мировом океане. Установлено, что если ПАВ содержит разветвлённый углеводородный радикал, то такие молекулы являются весьма устойчивыми для [[биологическое разложение|биодеградации]] (разложения) микроорганизмами. Напротив, линейные углеводородные цепи разлагаются легко, поэтому в производстве синтетических ПАВ необходимо использовать [[углеводороды нормального строения]]. | |
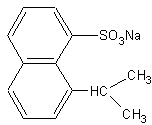
| − | + | * Пример синтетического моющего вещества — алкиларилсульфоната | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | *Пример синтетического моющего вещества | + | |
[[Изображение:Алкиларилсульфонат.gif]] | [[Изображение:Алкиларилсульфонат.gif]] | ||
| − | * | + | * Лаурилсульфат натрия (или аммония) используется почти повсеместно в шампунях и других косметических средствах |
[[Изображение:лаурилсульфат_натрия.gif]] | [[Изображение:лаурилсульфат_натрия.gif]] | ||
| − | + | == Литература == | |
| + | * Воюцкий С. С. Курс коллоидной химии. 2-е изд, М:Химия, 1976. | ||
[[Категория:Вещества]] | [[Категория:Вещества]] | ||
| − | |||
Текущая версия на 15:40, 7 марта 2009
Поверхностно-активные вещества (ПАВ)- вещества, добавление которых к жидкости снижает её поверхностное натяжение.
Снижение поверхностного натяжения происходит за счёт адсорбции молекул ПАВ на границе двух сред жидкость-жидкость(вода/эфир) или жидкость-газ(спирт/воздух). Адсорбция ПАВ происходит самопроизвольно, то есть изменение энергии Гиббса для этого процесса отрицательно (dG<0). Из этого следует, что взаимодействие между молекулами ПАВ и молекулами растворителя слабее, чем взаимодействие последних между собой, т.е. ПАВ как бы выталкивается из раствора на поверхность раздела.
Характерной особенностью строения ПАВ является их дифильность, т.е. сродство одной части молекулы к полярным, а другой к неполярным средам. Классический пример - натриевые или калиевые соли высших жирных кислот, где длинный углеводородный радикал имеет сродство к жирам, а карбоксильная группа- к воде. (т.к. сами эти кислоты очень плохо растворимы в воде, то используются Na- и K- соли, растворимость которых выше)
Классификация ПАВ
Различают катионогенные, анионогенные, и неионогенные ПАВ. В первых двух случаях молекулы ПАВ диссоциируют в растворе на ионы. Адсорбируются на границе раздела фаз, соответственно, у анионогенных ПАВ (пример- мыла, R-COONa, адсорбируются R-COO-), анионы, у катионогенных- катионы (пример- хлорид цетилпиридиния Py-(CH2)16-CH3*HCl, адсорбируется Py(+)-(CH2)16-CH3). Неионогенные ПАВ- недиссоциирующие молекулы, чаще всего это продукт взаимодействия высшего спирта с несколькими молекулами этиленоксида. В такой молекуле неполярным «хвостом» является углеводородный радикал, а полярным- этокси-олигомер.
Существенным преимуществом неионогенных ПАВ является то, что легко можно регулировать их гидрофильность, вводя определённое число этоксигрупп. Кроме того, они не образуют соли и могут применяться для мытья в жёсткой воде, а также можно использовать их сочетания с ионогенными ПАВ (если же смешать растворы анионогенного и катионогенного ПАВ, они нейтрализуют друг друга и дают соль, обычно очень труднорастворимую).
В настоящее время одной из серьёзных экологических проблем является загрязнение водных ресурсов синтетическими моющими веществами (мылами). Основным компонентов синтетических мыл являются алкилсульфокислоты или алкиларилсульфокислоты (можно встретить также названия алкилсульфонаты, алкилсульфоновые кислоты). Их достоинства — высокая моющая способность даже в очень жёсткой воде (в которой натуральные мыла выпадают в осадок) и в кислой среде (где натуральные мыла превращаются из натриевых солей в кислоты, нерастворимые в воде). Однако они не разлагаются, либо очень медленно разлагаются в естественных условиях, и соответственно накапливаются в водоёмах и Мировом океане. Установлено, что если ПАВ содержит разветвлённый углеводородный радикал, то такие молекулы являются весьма устойчивыми для биодеградации (разложения) микроорганизмами. Напротив, линейные углеводородные цепи разлагаются легко, поэтому в производстве синтетических ПАВ необходимо использовать углеводороды нормального строения.
- Пример синтетического моющего вещества — алкиларилсульфоната
- Лаурилсульфат натрия (или аммония) используется почти повсеместно в шампунях и других косметических средствах
Литература
- Воюцкий С. С. Курс коллоидной химии. 2-е изд, М:Химия, 1976.