Ангидриды
Ангидриды, окислы химических элементов, образующие при соединении с водой кислоты.
- В статье воспроизведен текст из Малой советской энциклопедии.
Ангидриды - так называются в химии соединения, образующиеся отнятием элементов воды от гидратов или водных окисей, т. е. такого рода тел, в которых присутствуют гидроксильные группы; отнятие это идет таким образом, что каждые два гидроксила дают, соединяясь, частицу воды, а избыточный кислород остается в соединении с тем остатком, к которому ранее примыкали гидроксильные группы. Например, гидрат окиси кальция Ca(ОН)2 выделяет воду при сильном прокаливании и переходит в окись кальция CaO; одна из гидроксильных групп при этом удаляется и тотчас же присоединяет к себе водород второй группы, тогда как кислородный атом этой последней остается в соединении с кальцием. Тела, содержащие только одну гидроксильную группу, не могут непосредственно давать ангидридов. Это становится возможным только в том случае, когда во взаимодействие вступают две частицы такого соединения. Например, азотная кислота NO2OH переходит в ангидрид таким образом, что при отнятии воды из одной частицы уходит гидроксильная группа, а из другой - водородный атом. Остающийся атом кислорода этой последней группы связывает оба остатка в новую частицу NO2O-O2 N, так называемый азотный ангидрид. Гидраты, содержащие более двух гидроксильных групп, могут терять их или все сразу, или по частям. Так, гидрат окиси железа Fe2(OH)6 может дать или нормальный продукт - безводную окись железа Fе2О3, или же такого рода соединение, где часть гидроксильных групп осталась нетронутой, напр. Fе2О2(ОН)2; последние формы соединений зовутся неполными ангидридами, или ангидрогидратами. Одна частица борной кислоты В(ОН)3 может дать один ангидрогидрат ВО(ОН), тогда как две частицы той же кислоты дают борный ангидрид В2О3 = ВОООВ, в котором кислородный атом является связующим звеном обоих остатков от каждой частицы борной кислоты. Образование ангидридов имеет место не только для неорганических, но очень часто также и для органических соединений. Так, две частицы одноосновной уксусной кислоты С2Н3O-ОН дают уксусный ангидрид ![]() а одна частица двухосновной янтарной кислоты C 2H4 (СООН) 2 - янтарный ангидрид
а одна частица двухосновной янтарной кислоты C 2H4 (СООН) 2 - янтарный ангидрид ![]() обыкновенный (серный) эфир С4Н10О является также ангидридом С2Н5ОС2Н5 этильного алкоголя С2Н5ОН; случай, аналогичный образованию янтарного ангидрида, будет представлять образование, напр., окиси этилена
обыкновенный (серный) эфир С4Н10О является также ангидридом С2Н5ОС2Н5 этильного алкоголя С2Н5ОН; случай, аналогичный образованию янтарного ангидрида, будет представлять образование, напр., окиси этилена ![]() из двухатомного спирта, этиленового гликоля С2Н4(ОН)2. Вследствие громадного разнообразия форм органических соединений, заключающих гидроксильные группы, является возможность образования не только полных и неполных ангидридов или ангидрогидратов, но также целых обширных классов смешанных ангидридов, происходящих на счет выделения воды из гидроксильных групп различного характера (алкогольного или кислотного); примером такого рода соединений могут служить для одноатомных соединений сложные эфиры, для двухатомных (алкогольных кислот) - особая форма их, лактоны; укажем на уксусный эфир
из двухатомного спирта, этиленового гликоля С2Н4(ОН)2. Вследствие громадного разнообразия форм органических соединений, заключающих гидроксильные группы, является возможность образования не только полных и неполных ангидридов или ангидрогидратов, но также целых обширных классов смешанных ангидридов, происходящих на счет выделения воды из гидроксильных групп различного характера (алкогольного или кислотного); примером такого рода соединений могут служить для одноатомных соединений сложные эфиры, для двухатомных (алкогольных кислот) - особая форма их, лактоны; укажем на уксусный эфир ![]() происходящий выделением воды на счет гидроксилов алкоголя и кислоты, их наипростейший лактон, получающийся из γ-оксимасляной кислоты CH2OH-CH2-CH2 -COOH, причем вода выделяется одновременно из алкогольного и кислотного гидроксилов, а остающийся кислородный атом связывает образующиеся остатки в бутиролактон
происходящий выделением воды на счет гидроксилов алкоголя и кислоты, их наипростейший лактон, получающийся из γ-оксимасляной кислоты CH2OH-CH2-CH2 -COOH, причем вода выделяется одновременно из алкогольного и кислотного гидроксилов, а остающийся кислородный атом связывает образующиеся остатки в бутиролактон
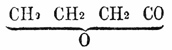 Некоторые гидраты до такой степени непрочны и так легко при обыкновенных условиях распадаются на воду и ангидрид, что их существование допускается только на основании соответствующих им производных. Так, можно допускать существование гидрата С(ОН4), или ортоугольной кислоты, а также и гидрата той же кислоты СО(ОН)2; но оба эти гидрата в момент выделения тем или другим путем из соответственных соединений распадаются на воду и угольный ангидрид СО2; столь же непрочен и гидрат SO(OH)2, или сернистая кислота, в свободном состоянии распадающаяся на воду и сернистый ангидрид SO2. Гидрат кремневой кислоты Si(OH)4, высушенный при 100°, переходит в ангидрид SiO2. Ортофосфорная кислота РО(ОН)3 при самом сильном прокаливании дает только ангидрогидрат РОО(ОН), тогда как едкое кали КОН остается без изменения при всякой температуре.
Некоторые гидраты до такой степени непрочны и так легко при обыкновенных условиях распадаются на воду и ангидрид, что их существование допускается только на основании соответствующих им производных. Так, можно допускать существование гидрата С(ОН4), или ортоугольной кислоты, а также и гидрата той же кислоты СО(ОН)2; но оба эти гидрата в момент выделения тем или другим путем из соответственных соединений распадаются на воду и угольный ангидрид СО2; столь же непрочен и гидрат SO(OH)2, или сернистая кислота, в свободном состоянии распадающаяся на воду и сернистый ангидрид SO2. Гидрат кремневой кислоты Si(OH)4, высушенный при 100°, переходит в ангидрид SiO2. Ортофосфорная кислота РО(ОН)3 при самом сильном прокаливании дает только ангидрогидрат РОО(ОН), тогда как едкое кали КОН остается без изменения при всякой температуре.
См. также
- Ангидриды кислот
- Ангидрит (минерал, не путать!)
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.