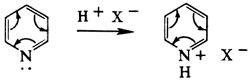Гетероциклические соединения
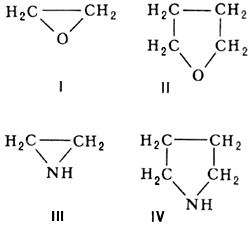
Гетероциклические соединения, гетероциклы (от гетеро… и греч. kýklos — круг), органические вещества, содержащие цикл, в состав которого, кроме атомов углерода, входят атомы других элементов (гетероатомы), наиболее часто N, О, S, реже — Р, В, Si и др. Многообразие типов Г.с. чрезвычайно велико, т.к. они могут отличаться друг от друга числом атомов в цикле, природой, числом и расположением гетероатомов, наличием или отсутствием заместителей либо конденсированных циклов, насыщенным, ненасыщенным или ароматическим характером гетероциклического кольца. Неароматические Г.с. по химическим свойствам близки к своим аналогам с открытой цепью; некоторые различия обусловлены эффектами напряжения в цикле и пространственными эффектами, связанными с циклической структурой. Так, окись этилена (I) и тетрагидрофуран подобны алифатическим эфирам простым, а этиленимин (III) и пиролидин (IV) — алифатическим вторичным аминам:
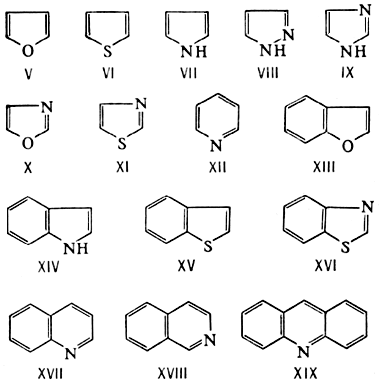
Ароматичность проявляется у Г. с.(главным образом 5- и 6-членных), содержащих, подобно другим ароматическим соединениям, замкнутую систему 4n+2 p-электронов. Химия таких Г. с., сохраняя известное сходство с химией ароматических соединений бензольного ряда, определяется в основном специфическим характером каждого гетероциклического ядра. К важнейшим ароматическим Г. с. относятся фуран (V), тиофен (VI), пиррол (VII), пиразол (VIII), имидазол (IX), оксазол (X), тиазол (XI) и пиридин (XII). Большое значение имеют также Г. с., конденсированные с бензольными ядрами, — бензофуран (кумарон; XIII), бензпиррол (индол; XIV), бензтиофен (тионафтен; XV), бензтиазол (XVI), бензпиридины — хинолин (XVII) и изохинолин (XVIII), дибензпиридин (акридин; XIX):
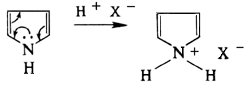
Ароматический характер фурана, тиофена, пиррола и их бензпроизводных определяется участием неподелённой электронной пары гетероатома в образовании замкнутой системы шести p-электронов. В кислой среде гетероатом присоединяет протон и система перестаёт быть ароматической.[1] Поэтому такие Г. с., как фуран, пиррол и индол, не выдерживают действия сильных кислот (тиофен устойчив к кислотам вследствие меньшего сродства серы к протону):
В 6-членных гетероциклах неподелённая электронная пара гетероатома не участвует в образовании ароматической системы связей. Поэтому пиридин — гораздо более сильное основание, чем пиррол, и с кислотами образует устойчивые соли:
Некоторые важные Г. с. могут быть получены из каменноугольной смолы, например пиридин и его гомологи, хинолин, изохинолин, индол, акридин, карбазол и др.; гидролизом растительных отходов (шелуха подсолнечника, солома и.т. п.) получают фурфурол. Однако наибольшее значение имеют синтетические методы, которые весьма разнообразны и специфичны; они рассмотрены в статьях, посвященных отдельным представителям Г. с. При синтезе чаще всего исходят из соединений с открытой цепью. Для некоторых 5-членных гетероциклов известны взаимные превращения. Так, фуран, пиррол и тиофен переходят друг в друга при действии соответственно H2O, NH3 или H2S при 450° над Al2O3 (см. Юрьева реакция).
Роль Г. с. в процессах жизнедеятельности растительных и животных организмов исключительно велика. К Г. с. относятся такие вещества, как хлорофилл растений и гемин крови, компоненты нуклеиновых кислот, коферменты, некоторые незаменимые аминокислоты (например, пролин и триптофан), почти все алкалоиды, пенициллин и некоторые другие антибиотики, ряд витаминов, например кобаламин (витамин B12), никотиновая кислота и её амид (витамин PP), растительные пигменты (антоцианины) ит. д. К Г. с. принадлежат многие широко применяемые в медицине синтетические лекарственные вещества, такие, как антипирин, амидопирин, анальгин, акрихин, аминазин, норсульфазол и другие. Г. с. широко применяют в различных отраслях промышленности (растворители, красители, ускорители вулканизации каучука ит. д.).
Литература
- А.Ф. Пожарский. Теоретические основы химии гетероциклов. М, Химия, 1985, 278 с.
- Каррер П.. Курс органической химии, пер. с нем., Л., 1962, 955 с.
- Джилкрист Т.. Химия гетероциклических соединений, пер. с англ., Мир, 1996, 463 с.
- Джоуль Дж., Смит Г.. Основы химии гетероциклических соединений, Мир, 1972.
Б. Л. Дяткин.
- Эта статья или раздел использует текст Большой советской энциклопедии.
- ↑ Пиррол и фуран проявляют "ацидофобность", и при действии сильных кислот полимеризуются. Тиофен, однако, в кислой среде образует устойчивые соли. На этом основана очистка бензола от примесей тиофена (неотделимых с помощью перегонки и иными способами) серной кислотой.