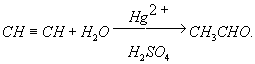Ацетальдегид
Ацетальдегид
- см. Альдегиды.
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.
Ацетальдегид, уксусный альдегид (см.).
- В статье воспроизведен текст из Малой советской энциклопедии.
Ацетальдегид, уксусный альдегид, CH3CHO, органическое соединение, бесцветная жидкость с резким запахом; температура кипения 20,8°C. Температура плавления — 124°С, плотность 783 кг/м3', смешивается во всех отношениях с водой, спиртом, эфиром. Ацетальдегид обладает всеми типичными свойствами альдегидов. В присутствии минеральных кислот он полимеризуется в жидкий тримерный паральдегид (CH3CHO)3 и кристаллический тетрамерный метальдегид (CH3CHO)4. При нагревании обоих полимеров в присутствии серной кислоты выделяется А.
Один из основных давно известных способов получения А. состоит в присоединении воды к ацетилену в присутствии солей ртути при температуре около 95°C (Кучерова реакция):
Ввиду дороговизны и токсичности ртути разработан другой способ прямой каталитической гидратации ацетилена. Возможен также вариант непрямой гидратации, заключающийся в присоединении к ацетилену спирта в присутствии твёрдого КОН с последующим омылением винилового эфира:
А. производится также из этилового спирта каталитическим отщеплением водорода при ~400°С. При действии алкоголятов алюминия А. превращается в этилацетат (Тищенко реакция):
метод имеет промышленное значение. Окисление А. кислородом воздуха над катализатором является промышленным методом получения уксусного ангидрида. А. легко вступает в альдольную конденсацию:
- 2CH3CHO ® CH3— CH(OH)— CH2—CHO.
Ацетальдегид применяют в огромных масштабах в производстве уксусной кислоты, уксусного ангидрида, различных фармацевтических препаратов и др.
- Эта статья или раздел использует текст Большой советской энциклопедии.