Гидролиз
Гидролиз (хим.). — Г. или, неправильно, гидролитической «диссоциацией» называется реакция разложения (ср. Вытеснение) водой тела, в ней растворенного (система, называемая обыкновенно гомогенной) или же находящегося в соприкосновении с водным раствором (система гетерогенная); в большинстве современных учебников по физической химии название Г. прилагается к первым системам, содержащим избыток воды и, как второе слагаемое, какую-нибудь соль. Явления, сюда относящиеся, подмечены уже давно. Так в работе над основными солями Г. Розе («Pog. An.», 83, 1851) указал, что многие металлические соли в водных растворах обладают кислой или щелочной реакцией на лакмус, несмотря на то, что количества основания и кислоты находятся в них в строго эквивалентном отношении, необходимом для нейтральности; так, напр., медный купорос, азотнокислая ртуть, хлорное железо и т. под. дают кислые растворы, а поташ, бура, цианистый калий и т. под. — растворы щелочные; для объяснения Розе предположил, что во всех подобных случаях вода вступает в химическое взаимодействие с растворенной солью, образуя одновременно гидрат окисла и гидрат кислоты; что такой процесс действительно имеет место при обыкновенной температуре — в некоторых случаях ему удалось доказать довольно убедительно; так, он нашел, что если взять концентрированный раствор буры, синящий лакмус, и прилить к нему уксусной кислоты до покраснения лакмуса, то прибавлением воды можно снова вызвать его посинение, что доказывает образование свободной щелочи (свободная борная кислота почти не действует на лакмусовый настой); параллельно с этим концентрированные растворы буры при приливании к раствору ляписа дают осадок борнокислого серебра, а при достаточном разбавлении они же осаждают гидрат окиси серебра и т. д.; присутствие свободной соляной кисл. в водном растворе сулемы (он кисл по реакции на лакмус) вероятно, потому что такой раствор действует разлагающим образом на мрамор (Арктовский; нет поводов допускать растворение мрамора в растворе HgCl2), a свободная соляная же кислота в водном растворе хлорного железа может быть обнаружена с помощью диализа (см. соотв. статью) слабых растворов (Дебрэ; система, им исследованная, усложнена осмотическими явлениями); Г. хлористоводородных солей слабых оснований изучен количественно (Уокер) нагреванием водных растворов этих солей с уксусно-метиловым эфиром, так как Оствальд показал ранее, что скорость Г. последнего пропорциональна количеству прибавленной свободной хлористоводородной кислоты и т. д. С громадным числом реакций Г. в гетерогенных системах приходится встречаться в аналитической химии; так, при действии раствора углекислых щелочей на соли магния осаждается основная углемагниевая соль благодаря Г. углекислого магния; «усреднение» растворов солей при 3-й и следующей аналитических группах приходится вести не до нейтральной реакции на лакмус, а до появления мути; сернистый аммоний осаждает гидраты окисей алюминия (исключительно) и хрома (предпочтительно) благодаря Г. сернистых алюминия и хрома (одновременно выделяется свободный сероводород); железо и алюминий осаждаются в виде основных уксуснокислых солей вследствие Г. средних уксуснокислых солей при кипячении (в жидкости появляется свободная уксусная кислота); magisterium bismuthi и хлорокись сурьмы являются продуктами Г. растворов азотнокислого висмута и хлористой сурьмы и т. д. Пока изучены почти исключительно явления Г. в слабых (содержащих громадный избыток воды) водных растворах, и теория этих процессов с точки зрения электролитической диссоциации дана Аррениусом. Изучение явления Г. в гетерогенных системах началось в последнее время; руководящей нитью является закон фаз. См. Ponsot, «Les Actualités chimiques» (I, 41-55, 1896); Nernst, «Theoretische Chemie» (4 изд., 514—517, 1903); Mellor, «Chemical Statics and Dynamics» (§§ 63-67 и конец § 114, 1904); Г. азотнокислого висмута, или, вернее, о системе Bi2O3-N2О5-H2 O см. Rutten, «Verh. Kgl. Ak. Amst.», 1900 («Ref. Z. ph. Ch.», 37, 504). Особняком стоит взгляд Вернера на явления Г. Исходя от своего представления о координатных числах химических соединений (см. соотв. статью), Вернер считает, что совершенно так же, как 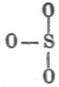

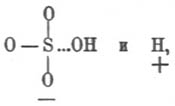
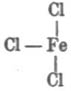
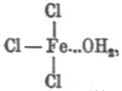
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.
Гидролиз, гидролитическое расщепление, гидролитическая диссоциация, разложение вещества с присоединением и под влиянием воды, напр. соли окиси железа в водном растворе разделяются на основание и кислоту. Чаще наблюдается явление Г. в органической химии, напр. расщепление мыла под влиянием воды на свободную щелочь и жирные кислоты. Иногда Г. совершается под влиянием катализаторов и гидролитических ферментов; так, сахар расщепляется в присутствии кислот или фермента — инвертазы.
- В статье воспроизведен текст из Малой советской энциклопедии.