Сурьма
Сурьма, химический элемент
(франц. Antimoine, англ. Antimony, нем. Antimon, лат. Stibium, откуда символ — Sb, или Regulus antimonii; атомн. вес = 120, если О = 16) — блестящий серебристо-белый металл, обладающий грубопластинчатым кристаллическим изломом или зернистым, смотря по быстроте застывания из расплавленного состояния. Сурьма кристаллизуется в тупых ромбоэдрах, весьма близких к кубу, как и висмут (см.), и имеет уд. вес 6,71-6,86. Самородная сурьма встречается в виде чешуйчатых масс, обыкновенно с содержанием серебра, железа и мышьяка; уд. вес ее 6,5-7,0. Это самый хрупкий из металлов, легко обращаемый в порошок в обыкновенной фарфоровой ступке. Плавится С. при 629,5° [1] и перегоняется при белом калении; была определена даже плотность пара ее, каковая при 1640° оказалась несколько большей, чем требуется для принятия в частице двух атомов — Sb2 [2]. Перегонять С. можно в токе сухого газа, напр. водорода, так как она легко окисляется не только на воздухе, но и в парах воды при высокой темп., превращаясь в окись, или, что то же, в сурьмянистый ангидрид:
- 2Sb + 3Н2O = Sb2O3 + 3Н2;
если расплавить кусочек С. на угле перед паяльной трубкой и бросить его с некоторой высоты на лист бумаги, то получается масса раскаленных шариков, которые катятся, образуя белый дым окиси. При обыкновенной температуре С. не изменяется на воздухе. По формам соединений и по всем химическим отношениям С. принадлежит в V группе периодической системы элементов, именно к менее металлической ее подгруппе, которая содержит еще фосфор, мышьяк и висмут; к последним двум элементам она относится так же, как олово в IV группе относится к германию и свинцу. Важнейших типов соединений С. два — SbX3 и SbX5, где она является трехвалентной и пятивалентной; очень вероятно, что эти типы в то же время и единственные. Галоидные соединения С. в особенности ясно удостоверяют только что сказанное о формах соединений.
Треххлористая сурьма. SbCl3 может быть получена уже по указанию Василия Валентина (XV века), именно при нагревании природной сернистой С. (Antimonium) с сулемой:
- Sb2S3 + 3HgCl2 = 2SbCl3 + 3HgS
при чем в реторте остается труднее летучая сернистая ртуть, a SbCl3 перегоняется в виде бесцветной жидкости, застывающей в приемнике в массу, подобную коровьему маслу (Butyrum Antimonii). До 1648 г. полагали, что летучий продукт содержит ртуть; в этом году Глаубер показал неверность такого предположения. При сильном нагревании остатка в реторте он также улетучивается и дает кристаллический возгон киновари (Cinnabaris Antimonii) HgS. Проще всего готовить SbCl3 из металлической С., действуя на нее медленным током хлора при нагревании Sb + 1 ½ Cl2 = SbCl3, причем по исчезновении металла получается жидкий продукт, содержащий некоторое количество пятихлористой С., избавиться от которого очень легко через прибавление порошкообразной сурьмы:
- 3SbCl5 + 2Sb = 5SbCl3;
в заключение SbCl3 подвергается перегонке. Чeрез нагревание сернистой С. с крепкой соляной кислотой в избытке получается раствор SbCl3, при чем развивается сероводород:
- Sb2S3+ 6HCl = 2SbCl3 + 3H2S.
Такой же раствор получается и при растворении окиси С. в соляной кислоте. При перегонке кислого раствора прежде всего отгоняется вода и избыточная соляная кислота, а потом гонится SbCl3 — обыкновенно желтоватая в первых порциях (вследствие присутствия хлорного железа) и после того бесцветная. Треххлористая С. представляет кристаллическую массу, которая плавится при 73,2° и кипит при 223,5°, образуя бесцветный пар, плотность которого вполне отвечает формуле SbCl3, а именно равна 7,8 по отношению к воздуху. Она притягивает влагу из воздуха, расплываясь в прозрачную жидкость, из которой может быть выделена снова в кристаллическом виде при стоянии в эксикаторе над серной кислотой. По способности растворяться в воде (в малых количествах) SbCl3 вполне сходна с другими, настоящими солями соляной кислоты, но большие количества воды разлагают SbCl3, превращая ее в ту или иную хлорокись, по уравн.:
- SbCl3 + 2Н2O = (HO)2 SbCl + 2НСl = OSbCl + Н2O + 2НСl
и
- 4SbCl3 + 5Н2O = O5Sb4Cl2 + 10HCl
которые представляют крайние пределы неполного действия воды (существуют хлорокиси промежуточного состава); большой избыток воды приводит к полному удалению хлора из сурьмяного соединения. Вода осаждает белый порошок подобных хлорокисей С., но часть SbCl3 может оставаться в растворе и переходить в осадок при большем количестве воды. Прибавляя соляной кислоты, можно осадок снова растворить, превратить его в раствор SbCl3. Очевидно, окись С. (см. далее) есть основание слабое, как и окись висмута, а потому вода — в избытке — способна отнимать от него кислоту, превращая средние соли С. в основные соли, или, в данном случае, в хлорокиси; прибавление соляной кислоты аналогично уменьшению количества реагирующей воды, почему при этом хлорокиси и превращаются в SbCl3. Белый осадок, получающийся при действии воды на SbCl3, называется порошком Альгорота по имени веронского врача, употреблявшего его (в конце XVI в.) для медицинских целей.
Если насыщать хлором расплавленную треххлористую С., то получается пятихлористая сурьма:
- SbCl3 + Cl2 = SbCl5
открытая Г. Розе (1835). Ее можно получить и из металлической С., порошок которой при всыпании в сосуд с хлором горит в нем:
- Sb + 2 ½ Cl2 = SbCl5.
Это бесцветная или слабо-желтоватая жидкость, которая дымит на воздухе и обладает противным запахом; на холоду она кристаллизуется в виде иголочек и плавится при −6°; она летучее SbCl3, но при перегонке частью разлагается:
- SbCl5 = SbCl3 + Cl2;
под давлением в 22 мм кипит при 79° — без разложения (в этих условиях темп. кипения SbCl3 = 113,5°). Плотность пара при 218° и под давлением в 58 мм равна 10,0 относительно воздуха, что отвечает приведенной частичной формуле (для SbCl5 вычисленная плотность пара равна 10,3). С вычисленным количеством воды при 0° SbCl5 дает кристаллический гидрат SbСl5 + Н2O, растворимый в хлороформе и плавящийся при 90°; с большим количеством воды получается прозрачный раствор, который при испарении над серной кислотой дает другой кристаллический гидрат SbСl5 + 4Н2O, уже не растворимый в хлороформе (Аншютц и Эванс, Вебер). К горячей воде SbCl5 относится, как хлорангидрид, давая с избытком ее кислый гидрат (см. ниже). Пятихлористая С. легко переходит в треххлористую, если присутствуют вещества, способные присоединять хлор, вследствие чего она часто применяется в органической химии для хлорирования; это — «передатчик хлора». Треххлористая С. способна образовать кристаллические соединения, двойные соли с некоторыми хлористыми металлами; подобные соединения дает и пятихлористая сурьма с различными соединениями и окисями. Известны соединения сурьмы и с прочими галоидами, а именно SbF3 и SbF5, SbBr3, SbJ3 и SbJ5.
Окись сурьмы, или сурьмянистый ангидрид, принадлежит к типу треххлористой С. и потому может быть представлена формулой Sb2O3, но определения плотности пара (при 1560°, В. Мейер, 1879), которая найдена равною 19,9 по отношению к воздуху показали, что этому окислу должно придавать удвоенную формулу Sb4O6, аналогично с мышьяковистым и фосфористым ангидридами. Окись С. встречается в природе в виде валентинита, образуя белые, блестящие призмы ромбической системы, уд. веса 5,57, и реже — сенармонтита — бесцветные или серые октаэдры, с уд. вес. 5,2-5,3, а также иногда покрывает в виде землистого налета — сурьмяная охра — различные руды С. Окись получается также при обжигании сернистой С. и возникает как окончательный продукт действия воды на SbСl3 в кристаллическом виде и в аморфном — при обработке металлической или сернистой С. разведенною азотною кислотою при нагревании. Окись С. обладает белым цветом, при нагревании желтеет, при более высокой температуре плавится и, наконец, улетучивается при белом калении. При охлаждении расплавленной окиси она получается в кристаллическом виде. Если нагревать окись С. в присутствии воздуха, то она поглощает кислород, превращаясь в нелетучий окисел SbO2, или, что вероятнее, в Sb2O4 (см. ниже). Основные свойства окиси С. весьма слабы, что уже указано выше; соли ее чаще всего основные. Из минеральных кислородных кислот почти одна серная способна давать соли сурьмы; средняя соль Sb2(SO4)3 получается, когда нагревают металл или окись с концентрированной серной кислотой, в виде белой массы и кристаллизуется из несколько разведенной серной кислоты в длинных, с шелковистым блеском иглах; вода разлагает ее на растворимую кислую и нерастворимую основную соль. Существуют соли с органическими кислотами, напр. основная сурьмяно-калиевая соль винной кислоты, или рвотный камень KO-CO-CH(OH)-CH(OH)-CO-O-SbO + ½ H2 O (Tartarus emeticus), довольно растворимая в воде (в 12,5 вес. част. при 21°). Окись С. обладает, с другой стороны, слабыми ангидридными свойствами, в чем легко убедиться, если приливать раствор едкого кали или натра к раствору SbCl3: образующийся белый осадок растворяется в избытке реактива, подобно тому как это имеет место для растворов солей алюминия. Преимущественно для калия и натрия известны соли сурьмянистой кислоты, например из кипящего раствора Sb2O3 в едком натре кристаллизуется сурьмянистокислый натрий NaSbO2+ 3H2O, в блестящих октаэдрах; известны еще такие соли — NaSbO2 + 2HSbO2 и KSbO2 + Sb2O3 [3]. Кислота соответствующая, то есть метакислота (по аналогии с названиями фосфорных кислот), HSbO2, однако, неизвестна; известны орто- и пирокислоты: H3SbO3 получается в виде тонкого белого порошка при действии азотной кислоты на раствор упомянутой двойной соли винной кислоты и имеет этот состав после высушивания при 100°; Н4Sb2O5 образуется, если подвергнуть щелочной раствор трехсернистой С. действию медного купороса в таком количестве, чтобы фильтрат перестал давать оранжевый осадок с уксусной кислотой — осадок тогда получается белый и имеет указанный состав.
Высший окисел типа пятихлористой С. есть сурьмяный ангидрид Sb2O5. Он получается при действии энергично кипящей азотной кислоты на порошок С. или на ее окись; образовавшийся порошок подвергают затем осторожному нагреванию; он содержит обыкновенно примесь низшего окисла. В чистом виде ангидрид можно получить из растворов солей сурьмяной кислоты, разлагая их азотной кислотой и подвергая промытый осадок нагреванию до полного удаления элементов воды; это — желтоватый порошок, нерастворимый в воде, однако, сообщающий ей способность окрашивать синюю лакмусовую бумажку в красный цвет. В азотной кислоте ангидрид совершенно нерастворим, в соляной же (крепкой) растворяется, хотя и медленно, вполне; при нагревании с нашатырем способен улетучиваться. Известны три гидрата сурьмяного ангидрида, обладающих составом, отвечающим гидратам фосфорного ангидрида. Ортосурьмяная кислота H3SbO4 получается из метасурьмянокислого калия через обработку его разведенной азотной кислотой и имеет надлежащий состав после промывки и сушения при 100°; при 175° она превращается в метакислоту HSbO3; оба гидрата суть белые порошки, растворимые в растворах едкого кали и трудно — в воде; при более сильном нагревании превращаются в ангидрид. Пиросурьмяная кислота (Фреми назвал ее метакислотой) получается при действии горячей воды на пятихлористую С. в виде белого осадка, который по высушивании на воздухе имеет состав Н4Sb2O7 + 2Н2O, а при 100° превращается в безводную кислоту, которая при 200° (и даже просто при стоянии под водой — со временем) превращается в метакислоту. Пирокислота растворимее в воде, чем ортокислота; она способна растворяться также в холодном нашатырном спирте, к чему ортокислота не способна. Соли известны только для мета- и пирокислоты, что дает, вероятно, право придать ортокислоте формулу HSbO3 + Н2O, считать ее гидратом метакислоты. Натриевая и калиевая метасоли получаются при сплавлении с соответственной селитрой порошка металлической С. (или из сернистой С.). С KNO3 получается после промывки водой белый порошок, растворимый в заметном количестве в воде и способный кристаллизоваться; выделенная из раствора и высушенная при 100° соль содержит воду 2KSbOЗ + 3H2O; при 185° она теряет одну частицу воды и превращается в KSbO3+ H2O. Соответствующая натриевая соль имеет состав 2NaSbOЗ + 7H2O, которая при 200° теряет 2H2О и делается безводной только при красном калении. Даже угольная кислота способна разлагать эти соли: если пропускать СО2 через раствор калиевой соли, то получается труднорастворимый осадок такой кислой соли 2K2O∙3Sb2O5 + 7H2O (это после высушивания при 100°, после сушения при 350° остается еще 2H2O). Если растворить метакислоту в горячем растворе аммиака, то при охлаждении кристаллизуется аммонийная соль (NH4)SbO3, трудно растворимая на холоду. Окисляя окись С., растворенную в едком кали (сурьмянисто-кислый калий), хамелеоном и испаряя затем фильтрат, получают кислый пиросурьмянокислый калий К2H2Sb2O7 + 4Н2O; эта соль довольно растворима в воде (при 20° — 2,81 ч. безводной соли в 160 ч. воды) и служит реактивом при качественном анализе на соли натрия (в среднем растворе), так как соответственная кристаллическая соль Na2H2Sb2O7 + 6H2O очень трудно растворима в воде. Это, можно сказать, наиболее трудно растворимая соль натрия, особенно в присутствии некоторого количества спирта; когда в растворе находится только 0,1 % натриевой соли, то и в этом случае появляется кристаллический осадок пиросоли. Так как сурьмяные соли лития, аммония и щелочноземельных металлов также образуют осадки, то, понятно, эти металлы должны быть удалены предварительно. Соли остальных металлов трудно растворимы или нерастворимы в воде; они могут быть получены через двойное разложение в виде кристаллических осадков и превращаются слабыми кислотами в кислые соли, а сильные кислоты вытесняют сурьмяную кислоту вполне. Почти все антимониаты растворимы в соляной кислоте.
При сильном нагревании на воздухе каждого из описанных окислов С. получается еще один окисел, именно Sb2O4:
- Sb2O5 = Sb2O4 + ½O2 и
- Sb2O3 + ½O2 = Sb2O4.
Этот окисел можно считать содержащим трехвалентную и пятивалентную С., то есть в таком случае это была бы средняя соль ортосурьмяной кислоты Sb SbO4 или основная — метакислоты OSb-SbO3. Этот окисел есть наиболее устойчивый при высокой температуре и представляет аналогию с суриком (см. Свинец) и в особенности с соответствующим окислом висмута Bi2O4 (см. Висмут). Sb2O4 представляет нелетучий белый порошок, весьма трудно растворимый в кислотах и получающийся вместе с Sb2O3 при обжигании природной сернистой С. — Sb2O4 обладает способностью соединяться со щелочами; при сплавлении с поташом после промывки водой получается белый продукт, растворимый в горячей воде и имеющий состав K2SbO5; это солеобразное вещество есть, быть может, двойная сурьмяно-калиевая соль ортосурьмяной кислоты (OSb)K2SbO4. Соляная кислота осаждает из раствора такой соли кислую соль K2Sb4O9, которую можно считать за двойную соль пиросурьмяной кислоты, именно (OSb)2K2Sb2O7. В природе встречаются подобные двойные (?) соли для кальция и для меди: ромеит (OSb)CaSbO4 и аммиолит (OSb)CuSbO4. В виде Sb2O4 можно взвешивать С. при количественном анализе; необходимо только промытое кислородное соединение металла прокаливать при хорошем доступе воздуха (в открытом тигле) и тщательно заботиться, чтобы горючие газы из пламени не попадали в тигель.
По способу образования сернистых соединений сурьма, как и мышьяк, может быть причислена к настоящим металлам с большим правом, чем, напр., хром. Все соединения трехвалентной С. в кислых растворах (лучше всего в присутствии соляной кисл.) при действии сероводорода превращаются в оранжево-красный осадок трехсернистой С., Sb2S3, который, кроме того, содержит еще воду. Соединения пятивалентной С., также в присутствии соляной кислоты, с сероводородом дают желтовато-красный порошок пятисернистой С. Sb2S5, содержащий обыкновенно еще примесь Sb2S3 и свободной серы; чистая Sb2S5 получается, когда при обыкновенной температуре прибавляют избыток сероводородной воды к подкисленному раствору сурьмяной соли (Бунзен); в смеси с Sb2S3 и серой получают ее, если пропускают сероводород в нагретый кислый раствор; чем ниже температура осаждаемого раствора и чем быстрее ток сероводорода, тем меньше получается Sb2S3 и серы и тем чище осаждаемая Sb2S5 (Bosêk, 1895). С другой стороны, Sb2S3 и Sb2S5, как и соответствующие соединения мышьяка, обладают свойствами ангидридов; это тиоангидриды; соединяясь с сернистым аммонием или с сернистыми калием, натрием, барием и проч., они дают тиосоли, напр. Na3SbS4 и Ba3(SbS4)2 или KSbS2 и проч. Эти соли аналогичны, очевидно, с кислородными солями элементов группы фосфора; они содержат двухвалентную серу вместо кислорода и называются обыкновенно сульфосолями, что ведет к спутанности понятий, напоминая о солях сульфокислот органических, которые лучше всего было бы всегда называть сульфононовыми кислотами[4]. Трехсернистая С. Sb2S3 под именем сурьмяного блеска представляет важнейшую руду С.; она довольно распространена среди кристаллических и более старых слоистых каменных пород; встречается в Корнваллисе, Венгрии, Трансильвании, Вестфалии, Шварцвальде, Богемии, Сибири; в Японии ее находят в виде особо крупных хорошо образованных кристаллов, а на Борнео встречаются значительные залежи. Кристаллизуется Sb2S3 в призмах и образует обыкновенно лучисто-кристаллические, серовато-черные массы с металлическим блеском; уд. вес 4,62; легкоплавка и легко измельчается в порошок, который марает пальцы подобно графиту и издавна (Библия, книга прор. Иезекииля, XXIII, 40) употреблялся как косметическое средство для подводки бровей; под именем «сурьмы» она употреблялась и, вероятно, употребляется еще для этой цели и у нас. Черная сернистая С. в торговле (Antimonium crudum) есть выплавленная руда; этот материал в изломе представляет серый цвет, металлический блеск и кристаллическое сложение. В природе, кроме того, встречаются многочисленные солеобразные соединения Sb2S3 с различными сернистыми металлами (тиооснованиями), напр.: бертьерит Fe(SbS2)2, вольфсбергит CuSbS2, буланжерит Pb3(SbS3)2, пираргирит, или красная серебряная руда, Ag3SbS3, и др. Руды, содержащие, кроме Sb2S3, сернистые цинк, медь, железо и мышьяк, суть так наз. блеклые руды. Если расплавленная трехсернистая С. подвергается быстрому охлаждению до затвердевания (вливают в воду), то она получается в аморфном виде и имеет тогда меньший уд. вес, именно 4,15, обладает свинцово-серым цветом, в тонких слоях просвечивает гиацинтово-красным и в виде порошка имеет красно-бурую окраску; она не проводит электричество, что свойственно кристаллическому видоизменению. Из так наз. сурьмяной печени (hepar antimontii), которая получается при сплавлении кристаллической Sb2S3 с едким кали или поташом и содержит смесь тиоантимониита и антимониита калия[5]:
- 2Sb2S3 + 4KOH = 3KSbS2 + KSbO2 + 2H2O
точно так же можно получить аморфную трехсернистую сурьму, для чего извлекают печень водой и профильтрованный раствор разлагают серной кислотой или кристаллическую Sb2S3 обрабатывают кипящим раствором КОН (или К2 СО3), а затем фильтрат разлагают кислотой; в обоих случаях промывают осадок сильно разведенной кислотой (винной под конец) и водой и высушивают при 100°. Получается легкий красно-бурый, маркий порошок сернистой С., растворимый в соляной кислоте, едких и углекислых щелочах гораздо легче, чем кристаллическая Sb2S3. Подобные препараты сернистой С., только не вполне чистые, известны с давних пор под именем «минерального кермеса» и находили применение в медицине и как краска. Оранжево-красный осадок гидрата Sb2S3, который получается при действии сероводорода на кислые растворы окиси С., теряет (промытый) воду при 100°-130° и превращается в черное видоизменение при 200°; под слоем разбавленной соляной кислоты в токе углекислого газа превращение это совершается уже при кипячении (лекционный опыт Митчелля, 1893 г.). Если прибавить сероводородной воды к раствору рвотного камня, то получается оранжево-красный (при проходящем свете) раствор коллоидальной Sb2S3, которая осаждается при прибавлении хлористого кальция и некоторых других солей. Нагревание в токе водорода приводит Sb2S3 к полному восстановлению металла, в атмосфере же азота она только возгоняется. Кристаллическая Sb2S3 идет на приготовление прочих соединений С., а также применяется как горючее вещество в смеси с бертолетовой солью и другими окислителями для пиротехнических целей, входит в состав головок шведских спичек и употребляется для иных запальных приспособлений, имеет также лекарственное значение — как слабительное для животных (лошадей). Пятисернистая С. может быть получена, как указано выше, или через разложение разбавленной кислотой упомянутых растворимых тиосолей:
- 2KЗ SbS4 + 6HCl = Sb2S5 + 6KCl + 3H2S.
Она в природе не встречается, но известна уже давно; Глаубер описал (в 1654 г.) получение ее из шлака, который образуется при приготовлении металлической С. из сурьмяного блеска при сплавлении его с винным камнем и селитрой, действием уксусной кислоты и рекомендовал как слабительное средство (panacea antimonialis seu sulfur purgans universale). С этим сернистым соединением приходится иметь дело при анализе: сероводород осаждает из подкисленного раствора металлы 4-й и 5-й аналитических групп; среди последних и находится С.; она осаждается обыкновенно в виде смеси Sb2S5 и Sb2S3 (см. выше) или только в виде Sb2SЗ (когда в осаждаемом растворе не было соединений типа SbX5) и затем отделяется действием многосернистого аммония от сернистых металлов 4-й группы, которые остаются при этом в осадке; Sb2S3 переводится многосернистым аммонием в Sb2S5 и затем вся С. оказывается в растворе в виде аммонийной тиосоли высшего типа, из которого по отфильтровании осаждается кислотою вместе с друг. сернистыми металлами 5-й группы, если таковые были в исследуемом веществе. Пятисернистая С. нерастворима в воде, легко растворима в водных растворах едких щелочей, их углекислых солей и сернистых щелочных металлов, также в сернистом аммонии и в горячем растворе аммиака, но не углекислого аммония. Когда Sb2S5 подвергается действию солнечного света или нагревается под водой при 98°, а также и без воды, но в отсутствие воздуха, то она распадается по уравнению:
- Sb2S5= Sb2S3 + 2S
вследствие чего при нагревании с крепкой соляной кислотой дает серу, сероводород и SbCl3. Тиосурьмянокислый нampий, или «соль Шлиппе», которая кристаллизуется в больших правильных тетраэдрах, бесцветных или желтоватых, состава Nа3SbS4 + 9Н2O, может быть получена при растворении смеси Sb2S3 и серы в растворе едкого натра определенной концентрации или путем сплавления безводного сернокислого натрия и Sb2S3 с углем и кипячения затем водного раствора полученного сплава с серой. Растворы этой соли имеют щелочную реакцию и соляной, холодящий и вместе с тем горьковато-металлический вкус. Подобным же образом может быть получена и калиевая соль, а бариевая возникает при растворении Sb2S5 в растворе BaS; эти соли образуют кристаллы состава K3SbS4 + 9H2 O и Ва3(SbS4)2 + 6Н2O. Пятисернистая С. употребляется при вулканизации каучука (см.) и сообщает ему известный буро-красный цвет.
Сурьмянистый водород, или стибин, SbH3. Если водород образуется в растворе, содержащем какое-либо растворимое соединение сурьмы (прибавляют, например, к смеси цинка и разведенной серной кислоты раствора SbCl3), то он не только восстановляет (в момент выделения) ее, но и соединяется с нею; при действии воды на сплавы С. с калием или натрием или разведенной кислоты на сплав ее с цинком точно так же образуется SbH3. Во всех случаях газообразный SbH3 получается в смеси с водородом; наиболее бедную водородом смесь можно получить (F. Jones), если приливать по каплям концентрированный раствор SbCl3 в крепкой соляной кислоте к избытку гранулированного или порошкообразного цинка, причем SbH3 частью разлагается (стенки колбы покрываются зеркальным налетом С.) и получается газообразная смесь, которая содержит SbH3 не более 4 %. Что чистый SbH3 нельзя иметь при обыкновенной темп., особенно ясно из опытов К. Ольшевского, который показал, что это вещество замерзает при −102,5°, образуя снегоподобную массу, плавится в бесцветную жидкость при −91,5° и кипит при −18°, и что жидкий SbH3 начинает разлагаться уже при — 65° — 56°. Полное разложение разбавленного водородом SbH3 происходит при 200° — 210°; он разлагается гораздо легче мышьяковистого водорода, что, вероятно, находится в связи с большим поглощением тепла при образовании из элементов (на граммов. частицу — 84,5 б. кал.)[6]. SbH3 обладает противным запахом и весьма неприятным вкусом; в 1 объеме воды при 10° растворяется от 4 до 5 об. SbH3; в такой воде рыбы гибнут через несколько часов. На солнечном свете, быстрее при 100°, сера разлагает SbH3 по уравн.:
- 2SbH3+ 6S = Sb2SЗ +3H2S
при чем получается оранжево-красное видоизменение Sb2S3; разлагающим образом действует, даже в темноте, и сероводород, который сам разлагается при этом:
- 2SbH3 + 3Н2S = Sb2S3 + 6Н2.
Если пропустить SbH3 (с Н2) в раствор азотнокислого серебра, то получается черный осадок, который представляет сурьмянистое серебро с примесью металлического серебра:
- SbH3 + 3AgNO3= Ag3Sb + 3HNO3;
это соединение С. встречается и в природе — дискразит. Растворы едких щелочей растворяют SbH3, приобретая бурый цвет и способность поглощать кислород из воздуха. Подобные же отношения характеризуют и мышьяковистый водород; оба водородистые соединения не обнаруживают ни малейшим образом способности давать производные аммониевого типа; они скорее напоминают о сероводороде и проявляют свойства кислот. Иных водородистых соединений С., более бедных водородом, судя по аналогиям, не известно с достоверностью; металлическая сурьма, полученная электролизом и обладающая способностью взрываться, содержит водород; быть может, здесь и присутствует подобное водородистое соединение, которое взрывчато, как бедные водородом ацетилен или азотистоводородная кислота. Существование летучего, газообразного даже, водородистого соединения для С. позволяет в особенности относить ее к числу неметаллов; а неметалличность ее находится, вероятно, в связи со способностью давать разнообразные сплавы с металлами.
Сплавы сурьмы. находят весьма значительное применение; присутствие в них С. обусловливает увеличение блеска и твердости, а при значительных количествах — и хрупкости сплавленных с нею металлов. Сплав, состоящий из свинца и С. (обыкновенно 4 ч. и 1 ч.), употребляется для отливки типографских букв, для чего часто готовят сплавы, содержащие сверх того значительное количество олова (10-25 %), а иногда еще и немного меди (около 2 %). Так наз. «британский металл» представляет сплав 9 ч. олова, 1 ч. С. и содержит медь (до 0,1 %); он употребляется для приготовления чайников, кофейников и т. под. посуды. «Белый, или антифрикционный, металл» — сплавы, употребляющиеся для подшипников; такие сплавы содержат около 10 % С. и до 85 % олова, которое иногда заменяется почти наполовину свинцом (Babbit’s metall), сверх того, до 5 % меди, количество которой падает в пользу С. до 1,5 %, если в сплаве находится свинец; 7 ч. С. с 3 ч. железа образуют при белом калении «сплав Реомюра», который очень тверд и дает при обработке напилком искры. Известны два кристаллических соединения с цинком (Cooke jr.) Zn3Sb2 и Zn2Sb2 и пурпуровый сплав с медью состава Cu2Sb (Regulus Veneris). Сплавы с натрием или калием, которые готовятся сплавлением С. с углекислыми щелочными металлами и углем, а также накаливанием окиси С. с винным камнем, в сплошном состоянии довольно постоянны на воздухе, но в виде порошков и при значительном содержании щелочного металла способны самовоспламеняться на воздухе, а с водой выделяют водород, дают едкую щелочь в растворе и порошок сурьмы в осадке. Сплав, который получается при белом калении тесной смеси 5 частей винного камня и 4 частей С., содержит до 12 % калия и употребляется для получения металлоорганических соединений С. (см. также Сплавы).
Металлоорганические соединения сурьмы получаются при действии цинкорганических соединений на треххлористую С.:
- 2SbCl3 + 3ZnR2= 2SbRЗ + 3ZnCl2,
где R = СН3 или C2H5 и пр., а также при взаимодействии RJ, йодистых спиртовых радикалов, с упомянутым выше сплавом С. с калием.
Триметилстибин Sb(CH3)3 кипит при 81°, уд. вес 1,523 (15°); триэтилстибин кипит при 159°, уд. вес 1,324 (16°). Это почти не растворимые в воде, обладающие запахом лука жидкости, которые самовоспламеняются на воздухе. Соединяясь с RJ, стибины дают йодистые стибонии R4 Sb-J, из которых — совершенно аналогично четырехзамещенным углеводородными радикалами йодистым аммониям, фосфониям и арсониям — можно получить основные гидраты окисей замещенных стибониев R4 Sb-OH, обладающие свойствами едких щелочей. Но, кроме того, стибины весьма сходны по своим отношениям с двухвалентными электроположительного характера металлами; они не только легко соединяются с хлором, серою и кислородом, образуя солеобразные соединения, напр. (CH3)3Sb=Cl2 и (CH3)3Sb=S, и окиси, например (CH3)3 Sb=O, но даже вытесняют водород из кислот, подобно цинку, напр.:
- Sb(C2Н5)3 + 2СlH = (С2H5)3Sb = Сl2 + Н2.
Сернистые стибины осаждают из соляных растворов сернистые металлы, превращаясь в соответствующие соли, например:
- (C2H5)3Sb = S + CuSO4 = CuS + (C2H5)3Sb=SO4.
Из сернокислого стибина можно получить раствор его окиси, осаждая серную кислоту едким баритом:
- (C2H5)3 Sb = SО4 + Ва(OН)2 = (С2H5)3 Sb = О + BaSO4 + Н2O.
Такие окиси получаются и при осторожном действии воздуха на стибины; они растворимы в воде, нейтрализуют кислоты и осаждают окиси настоящих металлов. По составу и строению окиси стибинов совершенно аналогичны окисям фосфинов и арсинов, но отличаются от них сильно выраженными основными свойствами. Трифенилстибин Sb(C6H5)3, который получается при действии натрия на бензольный раствор смеси SbCl3 с хлористым фенилом и кристаллизуется в прозрачных табличках, плавящихся при 48°, способен соединяться с галоидами, но не с серой или СН3 J: присутствие отрицательных фенилов понижает, след., металлические свойства стибинов; это тем более интересно, что соответствующие отношения аналогичных соединений более металличного висмута совершенно обратны: бисмутины BiR3, содержащие предельные радикалы, не способны к присоединениям вообще, a Bi(C6H5)3 дает (C6H5)3Bi=Cl2 и (C6H5)3 Bi=Вr2 (см. Висмут). Как будто электроположительный характер Вi необходимо ослабить электроотрицательными фенилами, чтобы получилось соединение, подобное металлическому двухвалентному атому.
Примечания
- ↑ По новейшим определениям (Heycock and Neville. 1895 г.).
- ↑ Именно В. Мейер и Г. Бильтц нашли в 1889 г. для плотности пара С. по отношению к воздуху следующие величины: 10,743 при 1572° и 9,781 при 1640°, что говорит о способности частицы ее диссоциировать при нагревании. Так как для частицы Sb2 вычисляется плотность 8,3, то найденные плотности говорят как бы о неспособности этого «металла» быть в состоянии простейшем, в виде одноатомной частицы Sb3, что отличает его от настоящих металлов. Те же авторы исследовали плотности пара висмута, мышьяка и фосфора. Только один висмут оказался способным дать частицу Bi1; для него найдены следующие плотности: 10,125 при 1700° и 11,983 при 1600°, а вычисленные для Bi1 и Вi2 плотности равны 7,2 и 14,4. Частицы фосфора Р4 (при 515° — 1040°) и мышьяка As4 (при 860°) диссоциируют от нагревания трудно, особенно Р4: при 1700° из 3Р4 только одна частица — можно думать — превращается в 2Р2, a As4 при этом претерпевает почти полное превращение в As2 Таким образом, самый металличный из этих элементов, составляющих одну из подгрупп периодической системы есть висмут, судя по плотности пара; свойства же неметалла принадлежат в наибольшей степени фосфору, характеризуя в то же время мышьяк и в меньшей степени — С.
- ↑ Быть может, эту соль можно рассматривать как основную двойную соль, калиево-сурьмяную, ортосурьмянистой кислоты —
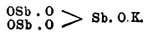
- ↑ Точно так же и названия сульфоангидриды (SnS2, As2S5 и проч.) и сульфооснования (N2S, BaS и проч.) следовало бы заменить тиоангидридами и тиооснованиями.
- ↑ Растворы такой печени очень способны поглощать кислород воздуха. Другой сорт печени, которая готовится из порошковатой смеси Sb2S3 и селитры (в равных количествах), причем реакция начинается от раскаленного уголька, брошенного в смесь, и идет весьма энергично при постепенном прибавлении смеси, содержит, кроме KSbS2 и KSbO2, еще K2SO4, a также некоторое количество сурьмяной кислоты (К-соли).
- ↑ Разлагаемостью при нагревании SbH3 можно пользоваться для качественного открытия соединений С. по способу Марша (см. Мышьяк).
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.