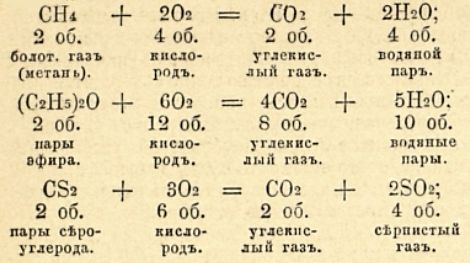Взрывчатые вещества — различия между версиями
EvgBot (обсуждение | вклад) м (→II. Разложение взрывчатых веществ) |
EvgBot (обсуждение | вклад) м (→II. Разложение взрывчатых веществ) |
||
| Строка 136: | Строка 136: | ||
Обращаясь к выводам, заметим, что они, говоря вообще, оправдали правило Бертело ("Mé canique chimique, par Berthelot, t. II, p. 467), по которому при воспламенении данного взрывчатого вещества сначала стремятся происходить разом, смотря по местным условиям, всякие реакции, возможные между присутствующими элементами без содействия внешней энергии, и притом каждая реакция со своей собственной скоростью. В конце некоторого короткого промежутка времени получится смесь различных соединений, относительные пропорции которых будут зависеть в особенности от этих скоростей. Если получающиеся соединения не способны реагировать друг на друга вследствие быстрого охлаждения, то все они и остаются существовать в общей смеси продуктов взрыва. Если же означенные соединения будут находиться в тесном прикосновении между собой при возвышенной температуре достаточное время, то они вступят между собой в такое взаимодействие, что окончательно получится система тел прочных, отвечающих наибольшему отделению тепла. Полученные при ближайшем изучении предмета результаты действительно подтверждают это правило: несмотря на разнообразие разложений в зависимости от местных условий, в них замечается стремление к образованию той системы продуктов, которая, будучи прочной, в то же время отделяет наибольшее количество тепла. а) Если вещество содержит в себе достаточное количество кислорода для полного сжигания горючих элементов, то получаются исключительно прочные продукты полного окисления, азот же выделяется в свободном состоянии. Так, разложение нитроглицерина точно отвечает уравнению: 2С<sub>3</sub>Н<sub>5</sub>(NO<sub>3</sub>)<sub>3</sub> = 6CO<sub>2</sub> + 5Н<sub>2</sub> О + 3N<sub>2</sub> + 0,5О<sub>2</sub>. То же самое имеет место для нитроманнита С<sub>6</sub> Н<sub>8</sub> (NО<sub>3</sub>)<sub>6</sub> и др. подобных соединений. Правило прилагается и к взрывчатым смесям, напр. к смеси пироксилина и азотно-аммиачной соли: C<sub>12</sub>H<sub>14</sub>O<sub>4</sub>(NO<sub>3</sub>)<sub>6</sub> + 10NH<sub>4</sub>NO<sub>3</sub> = 12CO<sub>2</sub> + 27H<sub>2</sub>O + 13N<sub>2</sub> + 0,5O<sub>2</sub>. Но такому именно способу разложения всех этих веществ отвечает и наибольшее количество отделяющегося тепла; при всякой другой комбинации элементов его отделилось бы меньше. Незначительные уклонения замечаются только для смесей, содержащих в себе KNO<sub>3</sub>, без сомнения — вследствие неоднородности состояния системы продуктов взрыва. б) Если же во взятом веществе содержится недостаточное количество кислорода, то ход разложения, вообще говоря, усложняется и состав продуктов изменяется отчасти с возрастанием плотности их или давления. Здесь представляются следующие случаи: случай 1-й — эндотермическое соединение содержит избыток горючих элементов, напр. гремучая ртуть, азотнокислый диазобензол. Разложение их таково: HgC<sub>2</sub>N<sub>2</sub>O<sub>2</sub> = 2CO + N<sub>2</sub> + Hg и 2C<sub>6</sub>H<sub>5</sub>N<sub>2</sub>NO<sub>3</sub> = 6СО + 6С + 5Н<sub>2</sub> + 3N<sub>2</sub>, то есть реакции идут в сторону образования окиси углерода. Получающиеся системы тел хотя могли бы дать место дальнейшему химическому взаимодействию с отделением тепла, напр. 2СО = СО<sub>2</sub> + С или 2СО + 2Н <sub>2</sub> = СО<sub>2</sub> + СН<sub>4</sub>, но, с одной стороны, эти последние реакции требуют более значительного времени, а после взрыва тотчас следует охлаждение, с другой — СО<sub>2 </sub> при возвышенной температуре есть тело непрочное, подвергающееся [[диссоциация|диссоциации]] с образованием СО и О, а свободный кислород тотчас окисляет накаленный уголь в СО, другими словами — система 2СО сравнительно с системой СО<sub>2</sub> + С есть прочнейшая. Кроме того, в приведенных уравнениях пренебрежено малыми количествами побочных продуктов; так, в 100 объемах продуктов взрыва гремучей ртути содержится 0,15 об. СО<sub>2</sub>. Количество этих не вошедших в уравнение продуктов (СH<sub>4</sub>, NH<sub>3</sub>, HCN и других соединений С с H и N) для азотнокислого диазобензола достигает 9 %, что обусловливается главн. обр. влиянием водорода. Случай 2-й — количество кислорода, оставаясь недостаточным, будет больше, чем сколько нужно для превращения всего углерода в СО, и вещество представляет собой экзотермическое соединение. Сюда относятся, например, пироксилин, пикриновая кислота и многие другие В. вещества. Продукты взрыва пироксилина при малых плотностях газов состоят из СО<sub>2</sub>, Н<sub>2</sub>О, СО, Н<sub>2</sub> и N<sub>2</sub>, и с возрастанием плотности наблюдается только увеличение пропорции углекислоты вследствие реакции Н<sub>2</sub>О + СО = СО<sub>2</sub> + Н<sub>2</sub>, идущей с отделением около +10 Кал.; когда же с дальнейшим возрастанием плотности газообразная смесь на счет этой реакции сильно обогатится водородом, начинает замечаться, кроме того, появление в незначительном количестве болотного газа вследствие реакции 2СО + 2Н<sub>2</sub> = СО<sub>2</sub> + СН<sub>4</sub>, происходящей с отделением около +61 Кал., то есть в рассматриваемом случае избыток кислорода, остающийся после превращения всего углерода в СО, распределяется между этим газом и водородом, с возрастанием плотности отходя все более и более к первому из них благодаря двум указанным побочным реакциям. Пренебрегая образованием болотного газа и выражая состав пироксилина формулой, придаваемой ему Вьейлем («Соmр. rend.», t. XCV, p. 132), C<sub>24</sub>H<sub>29</sub>O<sub>9</sub>(NO<sub>3</sub>)<sub>11</sub>, разложения его могут быть выражены следующими уравнениями: | Обращаясь к выводам, заметим, что они, говоря вообще, оправдали правило Бертело ("Mé canique chimique, par Berthelot, t. II, p. 467), по которому при воспламенении данного взрывчатого вещества сначала стремятся происходить разом, смотря по местным условиям, всякие реакции, возможные между присутствующими элементами без содействия внешней энергии, и притом каждая реакция со своей собственной скоростью. В конце некоторого короткого промежутка времени получится смесь различных соединений, относительные пропорции которых будут зависеть в особенности от этих скоростей. Если получающиеся соединения не способны реагировать друг на друга вследствие быстрого охлаждения, то все они и остаются существовать в общей смеси продуктов взрыва. Если же означенные соединения будут находиться в тесном прикосновении между собой при возвышенной температуре достаточное время, то они вступят между собой в такое взаимодействие, что окончательно получится система тел прочных, отвечающих наибольшему отделению тепла. Полученные при ближайшем изучении предмета результаты действительно подтверждают это правило: несмотря на разнообразие разложений в зависимости от местных условий, в них замечается стремление к образованию той системы продуктов, которая, будучи прочной, в то же время отделяет наибольшее количество тепла. а) Если вещество содержит в себе достаточное количество кислорода для полного сжигания горючих элементов, то получаются исключительно прочные продукты полного окисления, азот же выделяется в свободном состоянии. Так, разложение нитроглицерина точно отвечает уравнению: 2С<sub>3</sub>Н<sub>5</sub>(NO<sub>3</sub>)<sub>3</sub> = 6CO<sub>2</sub> + 5Н<sub>2</sub> О + 3N<sub>2</sub> + 0,5О<sub>2</sub>. То же самое имеет место для нитроманнита С<sub>6</sub> Н<sub>8</sub> (NО<sub>3</sub>)<sub>6</sub> и др. подобных соединений. Правило прилагается и к взрывчатым смесям, напр. к смеси пироксилина и азотно-аммиачной соли: C<sub>12</sub>H<sub>14</sub>O<sub>4</sub>(NO<sub>3</sub>)<sub>6</sub> + 10NH<sub>4</sub>NO<sub>3</sub> = 12CO<sub>2</sub> + 27H<sub>2</sub>O + 13N<sub>2</sub> + 0,5O<sub>2</sub>. Но такому именно способу разложения всех этих веществ отвечает и наибольшее количество отделяющегося тепла; при всякой другой комбинации элементов его отделилось бы меньше. Незначительные уклонения замечаются только для смесей, содержащих в себе KNO<sub>3</sub>, без сомнения — вследствие неоднородности состояния системы продуктов взрыва. б) Если же во взятом веществе содержится недостаточное количество кислорода, то ход разложения, вообще говоря, усложняется и состав продуктов изменяется отчасти с возрастанием плотности их или давления. Здесь представляются следующие случаи: случай 1-й — эндотермическое соединение содержит избыток горючих элементов, напр. гремучая ртуть, азотнокислый диазобензол. Разложение их таково: HgC<sub>2</sub>N<sub>2</sub>O<sub>2</sub> = 2CO + N<sub>2</sub> + Hg и 2C<sub>6</sub>H<sub>5</sub>N<sub>2</sub>NO<sub>3</sub> = 6СО + 6С + 5Н<sub>2</sub> + 3N<sub>2</sub>, то есть реакции идут в сторону образования окиси углерода. Получающиеся системы тел хотя могли бы дать место дальнейшему химическому взаимодействию с отделением тепла, напр. 2СО = СО<sub>2</sub> + С или 2СО + 2Н <sub>2</sub> = СО<sub>2</sub> + СН<sub>4</sub>, но, с одной стороны, эти последние реакции требуют более значительного времени, а после взрыва тотчас следует охлаждение, с другой — СО<sub>2 </sub> при возвышенной температуре есть тело непрочное, подвергающееся [[диссоциация|диссоциации]] с образованием СО и О, а свободный кислород тотчас окисляет накаленный уголь в СО, другими словами — система 2СО сравнительно с системой СО<sub>2</sub> + С есть прочнейшая. Кроме того, в приведенных уравнениях пренебрежено малыми количествами побочных продуктов; так, в 100 объемах продуктов взрыва гремучей ртути содержится 0,15 об. СО<sub>2</sub>. Количество этих не вошедших в уравнение продуктов (СH<sub>4</sub>, NH<sub>3</sub>, HCN и других соединений С с H и N) для азотнокислого диазобензола достигает 9 %, что обусловливается главн. обр. влиянием водорода. Случай 2-й — количество кислорода, оставаясь недостаточным, будет больше, чем сколько нужно для превращения всего углерода в СО, и вещество представляет собой экзотермическое соединение. Сюда относятся, например, пироксилин, пикриновая кислота и многие другие В. вещества. Продукты взрыва пироксилина при малых плотностях газов состоят из СО<sub>2</sub>, Н<sub>2</sub>О, СО, Н<sub>2</sub> и N<sub>2</sub>, и с возрастанием плотности наблюдается только увеличение пропорции углекислоты вследствие реакции Н<sub>2</sub>О + СО = СО<sub>2</sub> + Н<sub>2</sub>, идущей с отделением около +10 Кал.; когда же с дальнейшим возрастанием плотности газообразная смесь на счет этой реакции сильно обогатится водородом, начинает замечаться, кроме того, появление в незначительном количестве болотного газа вследствие реакции 2СО + 2Н<sub>2</sub> = СО<sub>2</sub> + СН<sub>4</sub>, происходящей с отделением около +61 Кал., то есть в рассматриваемом случае избыток кислорода, остающийся после превращения всего углерода в СО, распределяется между этим газом и водородом, с возрастанием плотности отходя все более и более к первому из них благодаря двум указанным побочным реакциям. Пренебрегая образованием болотного газа и выражая состав пироксилина формулой, придаваемой ему Вьейлем («Соmр. rend.», t. XCV, p. 132), C<sub>24</sub>H<sub>29</sub>O<sub>9</sub>(NO<sub>3</sub>)<sub>11</sub>, разложения его могут быть выражены следующими уравнениями: | ||
| + | |||
| + | {| border="1" align="center" class="TablePager" | ||
| + | | | ||
| + | | С<sub>24</sub>Н<sub>29</sub>О<sub>9</sub>(NO<sub>3</sub>)<sub>11</sub> | ||
| + | |- | ||
| + | |Плотность газов | ||
| + | | | ||
| + | |- | ||
| + | | 0,023 || 15СО + 9CO<sub>2</sub> + 9H<sub>2</sub>O + 5,5H<sub>2</sub> + 5,5N<sub>2 </sub> | ||
| + | |- | ||
| + | | 0,300 || 13СО + 11CO<sub>2</sub> + 7Н<sub>2</sub>О + 7,5Н<sub>2</sub> + 5,5N<sub>2 </sub> | ||
| + | |- | ||
| + | | 1,000 || 12СО + 12СО<sub>2</sub> + 6Н<sub>2</sub>О + 8,5Н<sub>2</sub> + 5,5N<sub>2 </sub> | ||
| + | |} | ||
| + | |||
| + | Для пикриновой кислоты, содержащей еще менее кислорода, реакции, уменьшающие пропорцию СО, проявляются резче, так что образованием болотного газа здесь уже нельзя пренебречь: | ||
| + | {| border="1" align="center" class="TablePager" | ||
| + | | | ||
| + | |8C<sub>6</sub>H<sub>2</sub>(NO<sub>2</sub>)<sub>3</sub>OH | ||
| + | |- | ||
| + | |Плотность газов | ||
| + | | | ||
| + | |- | ||
| + | | 0,100 || 5,5СО<sub>2</sub> + 42СО + 12N<sub>2</sub> + 0,5CH<sub>4</sub> + 8Н<sub>2</sub> + 3Н<sub>2</sub>О | ||
| + | |- | ||
| + | | 0,500 || 12,5СО<sub>2</sub> + 30,5СО + 12N<sub>2</sub> + 4,75СН<sub>4</sub> +2Н<sub>2</sub> + 0,5Н<sub>2</sub>О + 0,25С | ||
| + | |} | ||
| + | |||
| + | то есть между данными пределами плотности, в то время как только 2,5 частицы СО превратились в СО<sub>2</sub> на счет водяного пара, 9 частиц ее исчезли вследствие реакции с водородом. То же самое имеет место и при взрывах неполных азотных эфиров клетчатки, напр. так называемого коллодионного хлопка C<sub>24</sub>H<sub>32</sub>O<sub>12</sub>(NO<sub>3</sub>)<sub>8</sub>, отличающегося от обыкновенного пироксилина способностью растворяться в смеси спирта с эфиром и по содержанию кислорода ближе подходящего к пикриновой кислоте. | ||
| + | |||
| + | Хотя таким образом приведенные исследования и подтверждают правило Бертело, однако на основании его можно с точностью предвидеть уравнения разложения только для веществ, богатых кислородом, притом в условиях, наиболее благоприятных для полного окончания реакций. Если же пропорция кислорода недостаточна, то по мере уменьшения ее простые продукты окисления, вступая между собой и с водородом в дальнейшее взаимодействие, более и более дают начало новым продуктам, и тогда распределение кислорода между окисью углерода и водородом, равно как количество болотного газа, без непосредственного анализа является доныне не предусматриваемым. | ||
| + | |||
| + | Еще большую сложность представляют разложения таких смесей, содержащих недостаточное количество кислорода, как обыкновенный порох, так как, что бы ни делали, механическое смешение трех порошкообразных тел никогда не может достигнуть однородности настоящих химических соединений, и следовательно, осуществление одинаковости местных условий горения уже по этой одной причине здесь недостижимо. Отсылая для более близкого изучения разложения обыкновенного пороха к специальным сочинениям (напр. «Traité sur la poudre etc.», par Upmann et Meyer, traduite par Desortiaux), заметим здесь только, что согласно наиболее полному и обширному исследованию Нобля и Абеля состав продуктов взрыва почти не допускает выражения их каким-либо простым химическим уравнением. Главных продуктов, однако, только шесть — три газообразных СО<sub>2</sub>, СО, N<sub>2</sub>, три твердых K<sub>2</sub>SO<sub>4</sub>, K<sub>2</sub>CO<sub>3</sub>, K<sub>2</sub>S, и если взять средние количества их, выведенные из частных анализов, всегда более или менее отличающихся между собой, то разложение артиллерийского сорта пороха, по Дебусу, может быть представлено уравнением: 8KNO<sub>3</sub> + 3,5S + 10,5C = 6,5CO<sub>2</sub> + 1,5СО + 4 N<sub>2</sub> + 2,5K<sub>2</sub>СО<sub>3</sub> + 0,5K<sub>2</sub>SO<sub>4</sub> + K<sub>2</sub>S<sub>3</sub>. Бертело, имея в виду те же главные продукты взрыва и выражая состав артиллерийского пороха несколько отличающейся от предыдущей формулой 2KNO<sub>3</sub> + S + 3С, считает более вероятным рассматривать всякий случай разложения его как результат комбинации по два, по три и т. д. следующих 5 основных простых реакций, происходящих в различных точках массы: | ||
| + | |||
| + | : (1) 2KNO<sub>3</sub> + S + 3С = K<sub>2</sub>S + 3СО<sub>2</sub> + N<sub>2</sub>, | ||
| + | : (2) 2KNO<sub>3</sub> + 3С = К<sub>2</sub>СО<sub>3</sub> + СО<sub>2</sub> + СО + N<sub>2</sub>, | ||
| + | : (3) 2KNO<sub>3</sub> + 2,5С = К<sub>2</sub>СО<sub>3</sub> + 1,5СО<sub>2</sub> + N<sub>2</sub>, | ||
| + | : (4) 2KNO<sub>3</sub> + S + 2С = K<sub>2</sub>SO<sub>4</sub> + 2СО + N<sub>2</sub>, | ||
| + | : (5) 2KNO<sub>3</sub> + S + С = K<sub>3</sub>SO<sub>4</sub> + СО<sub>2</sub> + N<sub>2</sub>. | ||
| + | |||
| + | К подобному же заключению привели исследования Н. П. Федорова. Но, какова бы ни была суть дела, факт сложности и колебаний разложения смесей, подобных обыкновенному пороху, остается в полной своей силе, и, несомненно, главная причина его заключается в неоднородности смешения. | ||
| + | |||
| + | |||
| + | Указанные выводы относятся к продуктам, получающимся после охлаждения, но, спрашивается, одинаковы ли они с теми, которые существуют при максимуме температуры, развивающейся во время взрыва? С одной стороны, можно полагать, что некоторые из окончательных продуктов образуются во время охлаждения; так, по предположению Малляра и [[Ле Шателье]], первичные продукты суть всегда продукты прямого горения, то есть СО<sub>2</sub>, СО, H<sub>2</sub>O, H<sub>2</sub>, N<sub>2</sub>; такие же газы, как СH<sub>4</sub>, происходят вследствие вторичных реакций («Mé moriales des poudres et salpêtres», t. II). С другой стороны, несомненно, что СО <sub>2 </sub> и H <sub>2</sub> O при возвышенной температуре подвергаются так наз. ''диссоциации'' (см. это сл.). Из этих двух причин, могущих определить рассматриваемое нетождество продуктов взрыва, наибольшее значение имеет последняя. Бунзен («An. de Chimie et de Phys.», 4-e série, t. XIV, p. 446), исследуя гремучие смеси СО + O, Н<sub>2</sub> +О в [[1868]], пришел к заключению, что при максимуме температуры, развивающейся при взрыве, только 1/3 их находится в виде окончательных продуктов горения (Н<sub>2</sub>О и СО<sub>2</sub>), остальные же 2/3 остаются несоединенными и вступают в соединение лишь по мере охлаждения. Но позднейшие теоретические и экспериментальные исследования показали, что закон природы «действие равно противодействию» (см. Взаимодействие сил) управляет всеми химическими равновесиями и в том числе явлениями диссоциации. Ле Шателье, рассматривая влияние давления на диссоциацию СО<sub>2</sub>, Н<sub>2</sub> О и других подобных тел, заключает, что при весьма больших давлениях [[диссоциация]] должна быть ничтожно мала, так как СО + О и Н<sub>2</sub> + О превращаются в СО<sub>2</sub> и H<sub>2</sub> O с сокращением объема при постоянном давлении или с уменьшением давления в постоянном объеме, а по означенному закону — всякий раз, когда мы подобную систему, находящуюся в состоянии диссоциации, подвергаем увеличенному давлению, в ней непременно возбуждается процесс, стремящийся понизить давление, то есть наступает частное соединение остававшихся несоединенными частей, влекущее за собой повышение пропорции окончательных продуктов. Впоследствии Ле Шателье («Zeitschr. für Phys. u. Chemie», t. 2, s. 782) нашел из опытов кривую, показывающую, как падает постепенно коэффициент диссоциации СО <sub>2</sub> с увеличением давления и стремится к нулю при весьма высоких давлениях. Следовательно, на изменение состава окончательных продуктов при температурах взрыва диссоциация не может оказать заметного влияния вследствие именно громадных давлений, развиваемых взрывчатыми веществами в замкнутых пространствах или при очень быстром сгорании. | ||
| + | |||
| + | |||
| + | Большая или меньшая простота и правильность разложения имеет существенное значение для практических применений В. веществ, так как уравнением его определяется величина механического действия. Если реакции сложны и неопределенны, то от различия и случайности их должны проистекать различие и случайность механических действий. А так как взрывчатые химические соединения разлагаются с гораздо большей простотой и правильностью, чем взрывчатые смеси (порох), то там, где требуется правильность механического действия, им, очевидно, как более доступным управлению, сообразно различным целям практики должно быть отдано предпочтение перед взрывчатыми смесями. Говоря словами Бертело, при употреблении для стрельбы все преимущество грубой смеси, называемой обыкновенным порохом, перешедшей к нам по традиции от прошлых веков, состоит в том, что она развивает свою силу постепенно, но это касается уже другой стороны предмета — скорости разложения, и известным образом возможно умерить эту скорость и для взрывчатых химических соединений. | ||
| + | |||
| + | == III. Скорость разложения взрывчатых веществ == | ||
| + | При изучении этой стороны предмета нужно различать ''скорость собственно реакций'', происходящих в веществе, все части которого подвержены одинаковым условиям температуры, давления и др., от ''скорости распространения этих реакций'' в массе, части которой находятся в различных условиях. На практике обыкновенно приходится иметь дело с той и другой скоростью одновременно вследствие принятых способов возбуждения реакций в одной какой-либо точке заряда. Пусть разложение возбуждено с помощью накаленного тела или огня: воспроизведение условий, определяющих разложение от слоя к слою, может совершаться, вообще говоря, с различной скоростью в зависимости от окружающего давления, природы взрывчатого вещества, свойств оболочки и т. п. Наблюдая горение одного большого зерна или нескольких малых зерен обыкновенного пороха, мы замечаем сначала весьма быстрое распространение пламени по поверхности их (воспламенение) и затем более медленное проникновение пламени внутрь — сгорание концентрическими слоями. Если из пороховой смеси приготовить [[призма|призмы]] (от 0,5 до 2,5 килогр. весом) с боками, намазанными салом, и расположить их вертикально, то при зажжении верхнего основания происходит горизонтальными слоями горение, скорость которого легко измерить. Пиобер, производя такие опыты на открытом воздухе, нашел, что под обыкновенным давлением для французского артиллерийского пороха она равна от 10 до 13 мм в секунду. Подобным же образом можно изучать скорость горения и под увеличенными давлениями. Отто с этой целью впрессовывал пороховую смесь в трубку с дном, другой конец которой был открыт; изменение давления достигалось изменением количества впрессованного состава. Можно также при исследовании влияния очень больших давлений пользоваться данными о временах пробегания снарядами канала орудий, производя стрельбу изменчивыми количествами пороха и допуская, что заряды сгорают совершенно при вылете снарядов из дула; этим способом Костан нашел, что скорость горения артиллерийского пороха под средним давлением, получающимся в пушках большого калибра, около 320 мм в секунду. С понижением давления скорость горения, наоборот, быстро уменьшается. Так, по опытам Франкланда, произведенным в трубках, в которых постоянное давление во время горения поддерживалось выкачиванием газов с помощью насоса при давлении 722 мм, время сгорания заряда длиной в 152 мм равнялось 30,3 сек., а при давлении 405 мм оно было 45,5 секунд. Такие же результаты получил Сен-Робер при опытах на различных высотах Альп. Когда при понижении давлений дойдем наконец до пустоты, то скорость горения пороха падает настолько, что оно в этих условиях обнаруживается лишь медленным тлением (опыты Бойля, Гюйгенса и др.). Вообще, большая или меньшая скорость горения есть результат большей или меньшей быстроты, с которой нагретые газы удаляются от соседних порций несгоревшего вещества, другими словами — давление определяет число нагретых газообразных частиц, которые в каждое мгновение приходят в прикосновение с не воспламененными еще твердыми частицами. Так как число происходящих при этом ударов на поверхность взрывчатого вещества пропорционально давлению газов, то обозначая через v <sub>0</sub> и v скорости горения под атмосферным давлением р <sub>0</sub> и давлением р, можно написать: v/v <sub>0</sub> = (p/p<sub>0</sub>)<sup>''a''</sup>, где '' α '' должно быть определено из опыта. Результаты измерений показывают, что этот показатель для давлений, меньших 1 атмосферы, равен 0,66, а для значительно больших — величину его можно принять 0,5. Если бы горение происходило в постоянном объеме, то, каково бы ни было давление, начальная температура нагретых газовых частиц была бы чувствительно одна и та же. Но при горении под постоянным давлением, как в вышеизложенных опытах, газы производят внешнюю работу, причем температура их непременно понижается, притом под различными давлениями неодинаково. Кроме того, при производстве опытов неизбежно бывает охлаждение вследствие [[теплопроводность|теплопроводности]] и лучеиспускания. Поэтому под различными давлениями будет изменяться не только число частиц пороха, нагреваемых в единицу времени при ударах газовых частиц, но и температура нагревания, а именно: при малых давлениях вследствие более благоприятных условий охлаждения эта температура будет ниже, чем при высоких давлениях. Но изучение скоростей химических реакций вообще показывает, что с возрастанием температуры они увеличиваются с гораздо большей быстротой, чем температура; а следовательно, изменение скорости горения с давлением должно быть также результатом и большей или меньшей скорости самих реакций. Другие взрывчатые вещества не были столь подробно исследованы; однако отношения, замеченные для пороха, в большей или меньшей мере повторяются и для них. По наблюдениям Абеля («Liebig’s Jahresb.» [[1864]], s. 801), горение пироксилина в пустоте происходит столь медленно, что заметно лишь в темноте по являющемуся зеленоватому свету; под давлением около 25 мм замечается небольшое желтоватое пламя, а при давлениях начиная от 76 мм и более пламя делается блестящим. Окружающий разреженный газ при этом не остается без влияния: в то время, как воздух, азот, углекислота, окись углерода, водород, [[болотный газ]] не различаются чувствительно по своему действию, чистый кислород повышает напряженность горения, то есть для одинакового приблизительно замедления горения он требует большого разрежения, что объясняется отделением добавочного количества тепла вследствие дальнейшего горения продуктов разложения на счет кислорода и, следовательно, б''о''льшим нагреванием соседних порций пироксилина. Подобным образом происходит в пустоте и горение нитроглицерина. Гремучая ртуть, наоборот, в пустоте от соприкосновения с накаленной проволокой взрывает, но взрыв не передается соседним не прикасающимся порциям, которые только разбрасываются. Под обыкновенным атмосферным давлением, по Пиоберу, скорость горения пироксилина, взятого в виде рыхлой массы, в 8 раз больше, чем обыкновенного пороха; в прессованном же состоянии (в виде шашек или цилиндров, полученных из предварительно измельченной массы), по опытам Абеля, он сгорает медленнее, подобно обыкн. пороху. В таком изменении скорости горения в зависимости от консистенции вещества — изменении, наблюдаемом и у других взрывчатых веществ, прежде всего играет роль [[диффузия]] накаленных газов, которые легко проникают в рыхлую массу и ограничиваются только поверхностным слоем в прессованной. Кроме того, при этом важное значение имеет и [[теплопроводность]]. Волокна самого пироксилина обладают значительной теплопроводностью; воздух же, содержащийся между волокнами, представляет плохой проводник тепла. Очевидно, в прессованной массе, содержащей в своих порах сравнительно очень мало воздуха, теплота будет распространяться с большей легкостью по всему заряду, а следовательно, части, окружающие точку воспламенения, только в весьма незначительном слое успеют нагреться до температуры разложения. Насколько теплопроводность в самом деле влияет на быстроту горения, это может быть показано посредством следующего простого опыта: скрутив рыхлый пироксилин в нить, помещают последнюю на железный брусок и прикасаются к концу ее накаленным телом; нить тогда тлеет, так как тепло, отделяемое в каждой горящей точке, быстро отнимается железом, представляющим хороший проводник тепла. С другой стороны, скорость горения и прессованного пироксилина можно сильно увеличить, если перед зажиганием нагреем его до температуры несколько ниже точки взрывчатого разложения, напр. до 150°: тогда [[отвлечение]] тепла от точки воспламенения ослабится, одновременно будет нагреваться до точки взрыва большая часть окружающей массы, и последняя, будучи уже нагрета предварительно, скорее достигнет этой точки. Подобно прессованному пироксилину, сгорают на открытом воздухе также нитроглицерин (в динамитах) и взрывчатые смеси, содержащие в себе нитросоединения. Из последних — заключающие в себе азотно-аммиачную соль вследствие большой [[теплоемкость|теплоемкости]] как ее самой, так и образующейся при ее разложении воды вступают в горение только после предварительного нагревания выше 100°, при обыкновенной же температуре, начав гореть, скоро тухнут или даже совсем не загораются. Гремучая ртуть при воспламенении на открытом воздухе дает место настоящему взрыву, сходному с производимым другими веществами только в более или менее прочных оболочках. То же наблюдается с хлористым и йодистым азотом. | ||
| + | |||
| + | |||
| + | Указанные разности в скорости горения В. веществ на открытом воздухе относятся, однако, только к малым зарядам и определяются не только их химическим составом, физическими свойствами, консистенцией, но и сопротивлением окружающего воздуха. Вследствие того, что скорость разложения при передаче его от слоя к слою быстро растет с температурой и количество вещества, одновременно разлагающегося, увеличивается по мере распространения горения, при очень больших зарядах получатся иные отношения. Так, взятые в больших количествах прессованный пироксилин и нитроглицерин, начав гореть спокойно, окончательно так же взрываются на открытом воздухе, как и гремучая ртуть: по мере хода горения температура и с ней скорость разложения слоев постепенно повышаются; газы, вначале свободно преодолевавшие сопротивление атмосферы, испытывая все большее и большее затруднение в передвижении, образуют как бы более и более прочную оболочку для позднее сгорающих слоев, вследствие чего последние будут разлагаться под увеличенным давлением, пока наконец ядро массы не сгорит с наибольшей возможной скоростью. Таков именно механизм явлений, происходящих при пожарах в складах этих веществ, оканчивающихся обыкновенно всегда ужасными взрывами. Гремучая ртуть и вещества, ей подобные, тем только и отличаются главным образом, что способны взрываться на воздухе даже при зажигании малых количеств, то есть достигать сразу огромных скоростей разложения, при которых окружающие частицы воздуха не успевают уступить нарастающим давлениям и оттого представляют сопротивление расширению газов, сходное с сопротивлением более прочной оболочки. | ||
| + | |||
| + | |||
| + | [[Файл:Взрывчатые вещества b11 187-0.jpg|thumb|240px|Рис. 4. Аппарат для записывания (регистрирующий) времени, в течение которого происходит обжатие медных цилиндриков крешера. Взрыв происходит в бомбе В, а записывание на вращающемся цилиндре К. Вид сбоку и сверху.]] | ||
| + | С малыми зарядами большие скорости горения наблюдаются при воспламенении В. веществ лишь в прочных оболочках. Относящиеся сюда данные были добыты преимущественно Сарро и Вьейлем попутно при изучении давлений. Определяя промежутки времени, в течение которых происходило сжатие медных цилиндриков в крёшере (см. далее VIII), приспособленном к бомбе, из этих промежутков находилось время нарастания давлений до максимума, очевидно, соответствующее быстроте сгорания заряда. Для измерения означенных промежутков времени (см. рис. 4) бомба В, закрепленная в зажиме М, снабжалась крёшером С, так устроенным, что при опытах поршень его посредством прикрепленного легкого пера ''р'' мог чертить закон своего движения в течение сжатия цилиндрика на поверхности цилиндра К, вращающегося с известной скоростью. | ||
| + | |||
| + | Этот цилиндр покрывается закопченной бумагой и приводится в движение или с помощью электромотора, или посредством падающего груза; скорость вращения его определяется камертоном, снабженным пером, чертящим на бумаге в момент воспламенения [[синусоида|синусоиду]] S, волнам которой соответствует точно определенное предварительно время. До взрыва перо ''р'' чертит на цилиндре окружность ''а'', при взрыве — кривую ''ab'' и по окончании взрыва, когда прекратилось сжатие цилиндрика, — окружность ''b''. Расстояние между этими двумя окружностями, считаемое по производящей цилиндра К, равно полному сжатию цилиндрика крёшера. Расстояние между производящими, проведенными через ''а'' и ''b,'' деленное на скорость движения окружности цилиндра, равно времени сжатия цилиндрика крёшера. Из этих найденных описанным способом времен θ получены были следующие продолжительности горения τ (см. VIII) трех важнейших взрывчатых веществ: | ||
== Примечания == | == Примечания == | ||
Версия 02:39, 3 октября 2013
Взрывчатые вещества
— будучи при обыкновенных условиях более или менее постоянны, под влиянием накаливания, удара, трения и тому под. способны «взрывать», то есть быстро разлагаться, превращаясь в накаленные сжатые газы, стремящиеся занять большой объем. Происходящие газы, встречая преграды, производят на них давление, результатом чего являются: передача части живой силы взрыва частям преграды, перелом ее и измельчение, а иногда и отбрасывание с запасом живой силы частей, оказавших наименьшее сопротивление. Таким свойством взрывчатых веществ пользуются во множестве случаев, напр. при проведении туннелей, уничтожении подводных камней, выработке рудников, для движения механизмов (газовых двигателей), бросания ракет, стрельбы, действия мин при защите берегов и т. п.
Древние народы не знали взрывчатых веществ. Изучение их, начавшееся в XV столетии благодаря открытию пороха, бывшего ранее известным в Китае, имеет значение не только потому, что они оказывают множество услуг и часто сильно облегчают работу, действуя как молот, ударом, но даже и потому, что может предотвратить получение случайных взрывов и содействовать закономерному управлению силой взрывчатых веществ.
Предлагаемая статья содержит сведения: I) о составе взрывчатых веществ; II) о разложении их при взрыве; III) о скорости взрывов; IV) о детонации; V) об объеме газов; VI) о количестве отделяющегося при взрывах тепла; VII) о температуре при взрывах; VIII) о давлениях, развиваемых взрывчатыми веществами, и IX) о работе взрывчатых веществ[1].
Содержание
I. Состав взрывчатых веществ
Между взрывчатыми веществами известны твердые, жидкие тела и газы; напр. обыкновенный порох — твердое тело, нитроглицерин — жидкость, смесь светильного газа с воздухом — газ.
1) Если смешать между собой по возможности однородно, в известной пропорции, с одной стороны, тела, легко выделяющие при нагревании кислород, и с другой — тела горючие, способные через соединение с кислородом давать тепло и газообразные продукты, то получатся так называемые взрывчатые смеси, которые могут быть весьма разнообразны.
Простейшая из таких смесей есть гремучий газ, составленный из 2 об. водорода и 1 об. кислорода; сообщение огня какой-либо точке этой смеси вызывает почти мгновенное ее сгорание, то есть соединение взятых тел с образованием 2 об. водяного пара и отделением огромного количества тепла. Явление взрыва, наблюдаемое при воспламенении в закрытой оболочке, обусловливается собственно отделяющимся теплом: на счет его не только распространяется горение быстро от слоя к слою, но и происходит столь сильное нагревание водяного пара, что при взрыве в закрытой оболочке на стенки ее получается давление в 10 раз большее сравнительно с начальным давлением смеси. Так же точно содержится при зажигании смесь из 2 об. окиси углерода и 1 об. кислорода: она весьма быстро и с большим отделением тепла образует 2 об. углекислого газа, если его измерять после взрыва, приведя к начальной температуре и начальному давлению, при которых измерены начальные объемы. Вместо 1 об. кислорода на 2 об. водорода или на 2 об. окиси углерода можно было бы взять 4,8 об. воздуха, то есть смеси из 1 об. кислорода и 3,8 азота, причем рядом с продуктами горения — водой и углекислотой — получился бы свободный азот, в сущности же произошли бы те же явления, хотя и с меньшей интенсивностью, вследствие затраты тепла на нагревание азота, не принимающего участия в самом горении. Но вода и углекислота образуются при горении всяких органических веществ, как содержащих углеводородные элементы, поэтому и смеси их паров с кислородом или воздухом должны содержаться подобно предыдущим. Действительно, газообразные углеводороды, напр. светильный газ, пары летучих соединений, напр. эфира, бензина и т. п., образуют с воздухом взрывчатые системы; так назыв. рудничный газ есть не что иное, как смесь болотного газа с воздухом. Пары сернистого углерода, брызги нефти, угольная и серная пыль, крупинки крахмала и т. п., смешанные с воздухом, также могут дать место взрывам. Если прибавим, что свободный кислород во многих из таких смесей может быть заменен газообразными химическими его соединениями, легко разлагающимися, напр. закисью азота, окисью азота и т. п., то разнообразие В. смесей газов еще увеличится; так, 2 об. водорода с 2 об. закиси азота, взрываясь, превращаются в 2 об. водяного пара и 2 об. азота; или 2 об. циана с 4 об. окиси азота дают при воспламенении 4 об. углекислоты и 2 об. азота. При искусственном образовании взрывчатых смесей стремятся, чтобы взятое количество кислорода или вещества, его содержащего, было достаточно для полного сжигания горючих элементов смеси, напр. водорода и углерода. Нахождение наивыгоднейшей пропорции смешения по объему делается, изображая состав участвующих в превращении тел химическими частичными формулами, а само превращение — уравнениями, так как относительные весовые количества тел, соответствующие таким формулам, занимают в газообразном состоянии при одинаковых температуре и давлении равные объемы, а именно в 2 раза больший объем, чем объем весовой единицы водорода, по отношению к которому выражаются веса всех частиц. Тогда уравнение, взятое так, чтобы весь водород превращался в воду, углерод в углекислый газ, сера в сернистый газ и т. п., прямо укажет, в какой именно пропорции следует произвести смешение; оно в то же время дает и объем продуктов горения.
Например:
Изображение взрывчатых превращений химическими равенствами представляет наглядно и многие другие их свойства, почему ими пользуются постоянно. Небольшое уклонение от наивыгоднейшей пропорции кислорода не уничтожает взрывчатости системы; оно только меняет состав продуктов, обусловливая появление в них или свободного кислорода (в случае его избытка), или продуктов неполного горения, напр. окиси углерода (в случае избытка горючего газа, содержащего углерод). Но, постепенно увеличивая уклонение как в одну, так и в другую сторону, мы дойдем до пределов, когда горение перестает распространяться само собой, и тогда явление взрыва не наблюдается; причина этого заключается в том, что при большом избытке одного из смешанных газов температура в слоях, окружающих место возбуждения горения, этим избытком сильно понижается и нагревание их не достигает точки воспламенения. Но все перечисленные газовые смеси не могут употребляться в роли собственно взрывчатых веществ по причине очень большого объема, занимаемого ими в обыкновенных условиях. Единственная, которая получила техническое применение, это — смесь светильного газа с воздухом, употребляемая для движения в газомоторах (см. Газовые двигатели).
Конечно, можно было бы газообразные В. смеси, способные легко принимать жидкое состояние, напр. этилен C 2H4 и закись азота N 2 O, посредством охлаждения и давления превратить в жидкие взрывчатые смешения, занимающие малый объем и подобные настоящим взрывчатым жидкостям; но проще взять как горючие, так и поддерживающие горение вещества, имеющие это состояние в обыкновенных условиях. Останавливаясь собственно на выборе жидкостей, поддерживающих горение, обращают на себя внимание главным образом две — азотноватый ангидрид NО 2, кипящий при 26°, и дымящаяся азотная кислота HNO 3, кипящая при 86°. И действительно, как с первым, так и с последним сжигающим деятелем может быть приготовлен ряд взрывчатых жидких смесей через растворение в них различных горючих соединений. Смешивая сернистый углерод CS 2, бензол С 6 Н 6 и т. п. с азотноватым ангидридом, получают панкластиты, открытые Турпеном, напр.:
- CS2 [cероуглерод] + 3NO2 [азотнов. ангидр.] = СО2 [углек. газ] + 2SO2 [сернис. газ] + 1,5N2 [азот].
Смешения дымящейся азотной кислоты с нитробензолом С6Н5NО2 и другими подобными соединениями представляют собой так наз. кислые взрывчатые вещества Шпренгеля:
- C6H5NO2 [нитробензол] + 5HNO3 [азотная кисл.] = 6СО2 [углек. газ] + 5H2O [вода] + 3N2 [азот].
При взрыве как тех, так и других имеет место не только выделение огромного количества тепла, но и большое увеличение объема системы; так, литр панкластита вышеприведенного состава весом около 1,28 кил. дает 601,6 литров газов при нормальных условиях. Но, кроме малого начального объема, эти смеси представляют преимущество, важное в технической практике, в том отношении, что могут легко приготовляться непосредственно перед самым взрывом из веществ невзрывчатых и потому безопасных при перевозке.
Представителем твердых взрывчатых смесей служит обыкновенный порох. Горючие элементы в нем сера S и уголь С; сжигающий деятель — калийная селитра KNO3. Смешение, рассчитанное на полное сгорание, отвечает частичному составу 10KNO3 + 3S + 8С. При сообщении огня селитра выделяет азот N и кислород О, оставляя окись калия К2 О; сера и уголь с кислородом превращаются в серный ангидрид SО3 и углекислоту СО2; окись калия, соединяясь с ними, дает твердые труднолетучие соли — сернокислую K2SO4 и углекислую K2СО3:
- 10KNO3 + 3S + 8С = 3K2SO4 + 2K2СО3 + 6CO2 + 5N2.
Но обыкновенно приготовляются сорта пороха с меньшим содержанием селитры, так как этим способом для единицы веса удается достигнуть увеличения объема газов, развивающихся при взрыве, а равно осуществить и некоторые другие задачи, важные при употреблении для стрельбы; напр. состав (приближенный) охотничьего сорта выражается формулой 16KNO3 + 6S + 13С, артиллерийского 2KNO3 + S + 3С; причем, понятно, в вышеозначенных продуктах взрыва должны появиться также вещества, не вполне окисленные, а именно: в газообразных — окись углерода СО, а в твердых — сернистый калий K2 S. Вместо калийной селитры можно взять другие азотнокислые соли, напр. NaNO3, NH4NO3, Ва(NO3)2 или бертолетову соль KСlO3 и хлорно-калиевую соль КСlO4. Кроме того, здесь могут применяться также марганцово-калиевая KМnО 4 и двухромовокалиевая соли K2Сr2О7, перекиси и другие подобные вещества, легко выделяющие при нагревании кислород. Вместо угля (или также и серы), с другой стороны, можно употреблять различные твердые органические тела, напр. клетчатку, крахмал C6H10O5, тростниковый сахар С12Н22О11, парафин СnН2n+2, нафталин С10 Н 8, уксусно-натриевую соль — NaC 2H3O2, синеродистые и железисто-синеродистые соли, напр. KCN, K4Fe(CN)6, Pb2Fe(CN)6, многие сернистые металлы, напр. CuS, Sb2S3 и др., так как все эти тела способны гореть в кислороде. Какую бы ни взяли смесь из перечисленных тел, везде получим в большей или меньшей мере В. вещества, потому что везде будут присутствовать тела, легко выделяющие много кислорода, и тела, дающие при своем горении газы. И в самом деле, в различное время было предложено много разнообразных смешений, подобных обыкновенному пороху, напр. саксифрагин — из Ва(NO3)2 (с незначительной примесью KNO3) и С; амидный порох — из NH4NO3, KNO3 и С; галлоксилин — из KNO3, С, древесных опилок и K4Ее(СN)6; порох Ожандра — из КСlO3, K4Fe(CN)6 и C12H22O11 и т. п. Замена одних составных частей другими одинакового значения, хотя бы и в соответствующей пропорции, влечет за собой изменение в объеме газов и в количестве тепла. Возьмем, напр., вместо калийной селитры эквивалентные количества (то есть выделяющие то же количество кислорода) других азотнокислых солей, при чем газообразные продукты взрыва получатся сходственные и при одном и том же количестве угля и серы ни объем газов, ни количество тепла приблизительно не изменятся. Но, если делать расчет на единицу веса пороха, влияние эквивалентов сжигающих деятелей тотчас выступает на первый план. Пусть замена сделана на Ba(NO3)2: так как эквивалент (частичный вес) KNO3 есть 101, а эквивалент Ва(NO3)2 (половина частичного веса) 130,5, то поэтому на одно и то же количество серы и угля для образования сходственных продуктов горения придется взять Ba(NO3)2 на 1/3 более, т е. общий вес новой смеси будет больше, а следовательно, единица веса ее даст и газов, и тепла меньше. Обратное получится при замене KNO3 на NaNO3, потому что эквивалент последней соли менее, а именно равен только 85, то есть единица веса смеси с NaNO3 выделит и тепла, и газов больше. Пусть, далее, вместо KNO3 употреблена азотнокислая соль меди Сu(NО3)2: в то время как KNO3, NaNO3, Ba(NO3)2 превращаются при взрыве в K2O, Na2O, ВаО, образующие с СО2 и SО3 прочные соли, Cu(NO3)2 дает чистую медь, то есть производит сжигание не только кислородом элементов азотной кислоты, но и кислородом, соединенным с самой медью; а следовательно, с KNO3 будут эквивалентны 5/12Cu(NO3)2, или эквивалент этой соли в пороховых смесях равен 78, и с рассматриваемой точки зрения она еще выгоднее, чем NaNO 3. Но так как пороха с NaNO3 и Cu(NO3)2 гигроскопичны, то они и непригодны для дела.
2) Во взрывчатых смесях частицы тел горючих и тел, поддерживающих горение, существуют отдельно; оттого при образовании наиболее типических из них (газовых и твердых) обыкновенно не наблюдается никаких внешних явлений, указывающих на внутренние частичные работы; оттого же в твердых смесях, где частицы не обладают подвижностью, никогда нельзя достигнуть совершенной однородности состава. Но можно представить, что элементы горючие и сжигающий кислород (в достаточной пропорции) совмещены в одной и той же химической частице — в однородном химическом соединении; таковы, например, азотно-аммиачная соль NH4NO3, щавелевокислые соли серебра Ag 2C2O4 и ртути HgC2O4, хлорнокислый СН3СlO4 и азотнокислый метил СН3NО3 и т. п. Все подобные соединения, обладая сравнительно малой устойчивостью, при сообщении огня стремятся превратиться в систему тел наиболее прочных, каковыми являются СО2, СО, H2O, HCl, N2, то есть дают место как бы внутричастичному сгоранию, напр.:
- NH4NO3 = 2Н2О + N2 + О;
- Ag2C2O4 = 2СО2 + 2Ag и пр.
Однородность состава обеспечивается здесь самим актом химического соединения. Нечто подобное в этом отношении может быть у взрывчатых растворов, которые потому составляют переход к настоящим взрывчатым химическим соединениям. Наибольшее число представителей рассматриваемых соединений относится к так называемым нитросочетаниям органических веществ, образующимся из элементов с выделением тепла. Как известно, многие углеродистые вещества при обработке азотной кислотой выменивают часть своего водорода на так называемую нитрогруппу (NO2). Смотря по натуре органических веществ, эта реакция ведет к образованию или азотных эфиров, или нитросоединений.
а) Азотные эфиры, получающиеся при действии [[|азотная кислотf|азотной кислоты]] на алкоголи и характеризующиеся способностью разлагаться кислотами и щелочами с возрождением первоначальных веществ, суть не что иное, как алкоголи, водный водород которых вполне или отчасти замещен нитрогруппами, а именно Rn(NO2O)n, где Rn изображает сложную группу атомов, в которой могут содержаться С, H и О. Очевидно, предельное число нитрогрупп, а вместе с тем и число паев кислорода, входящих в частицу эфира, будет условливаться атомностью (числом водных групп) данного алкоголя; от количества же кислорода находится в зависимости способность к более или менее совершенному внутричастичному сгоранию. Вследствие этого взрывчатые свойства обыкновенно являются наиболее развитыми в полных азотных эфирах многоатомных алкоголей. Таковы суть: эфиры глицерина С3Н5(NO3)3 (нитроглицерин), эритрита С4Н6(NO3)4 (нитроэритрит), маннита C6H8(NO3)6 (нитроманнит), различных углеводов, а именно — молочного сахара С12Н17О6(NO3)5 (пентанитросахароза), клетчатки С12Н14О4(NО3)6 (пироксилин) и др.
б) Нитросоединения, отличающиеся от азотных эфиров по неспособности показывать чистые реакции распадения с образованием первоначальных веществ, представляются как органические вещества, в которых нитрогруппы замещают часть углеводородного водорода Rn(NO2)n. С особенной легкостью они получаются при действии азотной кислоты на тела т. н. ароматического ряда, напр. нитронафталин C10H7(NO2), бинитробензол С6Н4(NО2)2, тринитрофенол C6H2(NO2)3ОH (пикриновая кислота), тринитрокрезол С 6 Н(СН 3)(NO2)3 OН и т. п.
В практике, однако, редко употребляют указанные соединения в чистом состоянии. Так, нитроглицерин применяется в технике главн. образ. в виде смесей его с кремнеземом, называемых динамитами с недеятельным поглотителем; точно так же вместо чистого пироксилина чаще всего употребляют смеси его с водой в виде прессованных шашек под именем влажного пироксилина и т. п. Примешивание инертных веществ имеет целью или умерить силу взрывчатого действия, или сообщить массе безопасность при перевозке, хранении, приготовлении зарядов и пр. Но преимущественно посредством смешения с другими телами стараются поправить состав нитрированных веществ, который обусловливается химическими законами и в то же время далеко не всегда соответствует наивыгоднейшему отношению между количествами кислорода и горючих элементов. В самом деле, в азотных эфирах углеводов, во всех ароматических нитросоединениях содержание кислорода недостаточно для полного сгорания углерода и водорода; таковые, очевидно, полезно смешивать с селитрами и другими сжигающими деятелями. Некоторые из них по недостаточности кислорода совсем даже не могут быть употребляемы без прибавления окислителей. Отсюда происходят ряды новых взрывчатых смесей, отличающихся от вышерассмотренных тем, что горючие части в них сами по себе взрывчаты: напр. смеси пироксилина с KNО 3, пикриновые пороха [смеси пикриновых солей C6H2(NO2)3 OM с соответственными МNО 3], смеси, содержащие нитроуглеводороды [C6H4(NO2)2, C10H7(NO2) с MNO3 или HNО 3] и т. п. Наоборот, в нитроглицерине, нитроманните содержится избыток кислорода; таковые полезно смешивать с горючими веществами. Во взрывчатых смесях этого рода самостоятельная взрывчатость принадлежит сжигающему деятелю; сюда относятся многие динамиты с деятельным основанием, напр. целлюлозный динамит, в котором поглотителем нитроглицерина служит древесная масса. Но, очевидно, можно осуществить и такие смеси, в которых и горючие части, и сжигающий деятель будут вещества сами по себе взрывчатые; это, напр., имеет место в так назыв. студенистом динамите, или взрывчатом желатине, где нитроглицерин сопоставлен с пироксилином, а также в смесях нитросоединений с азотно-аммиачной солью.
3) Все вышерассмотренные вещества развивают и газы и теплоту вследствие горения. Но то и другое (газы и теплота) может получиться при простом распадении некоторых соединений, вследствие чего последние также являются веществами взрывчатыми. Таковы именно различные вещества, образованные из элементов с поглощением тепла (эндотермические) при содействии посторонней энергии, доставляемой чаще всего одновременным совершением какой-либо отделяющей тепло (экзотермической) реакции. Сюда относятся многие В. вещества, весьма интересные в химическом отношении, но практическим значением не обладающие:
а) Простейшие соединения азота: хлористый азот NCl3, йодистый азот NHJ2, азотистая ртуть N2Hg3, сернистый азот NS и др.
б) Окислы хлора — хлорноватистый ангидрид Сl2О, хлорноватая окись СlО2 и др.
в) Некоторые соединения, разлагающиеся со взрывом с помощью небольшого количества воспламененной гремучей ртути, — ацетилен С2Н2, циан С2N2, окись азота NO, сернистый углерод CS2 и др.
г) Диазосоединения, получающиеся при действии азотистой кислоты на разнообразные амидосоединения ароматического ряда.
Сообщение огня приведенным соединениям производит простое распадение их на первоначальные элементы и освобождение тепла, поглощенного при их образовании. Так, хлористый азот (жидкость уд. в. 1,65), разлагается по уравнению:
- 2NCl3 = N2 + 3Сl2,
и граммовая частица его (частичный вес, выраженный в граммах), равная 120,5 граммам, выделяет при этом 57,8 больших калорий, или 57800 малых калорий (Сен-Клер-Девилль и Готфейль «An. de Chim. et de Phys.», т. LXIX, p. 152).
Явления поглощения тепла играют существенную роль и в вышерассмотренных нитрированных веществах. Легкая разлагаемость азотной кислоты и сильное сжигательное действие ее на углеродистые водороды зависят именно от того, что все кислородные соединения азота представляют собой соединения (эндотермические), образованные с поглощением тепла.
4) Наконец, ныне известны многие такие химические соединения, при взрыве которых будут иметь место одновременно оба выше установленных фактора взрывчатости: и распадение с освобождением поглощенной при их образовании энергии, и внутричастичное горение. Таковы, например, соли диазобензола — азотнокислая C6H5N2NO3, хромовокислая (С6Н5N2)2СrО4, гремучекислые соли ртути С2 НgN2 О2, серебра C2Ag2N2O2 и друг., так как при взрыве их углерод вполне или отчасти сгорает в окись углерода и в то же время все они образованы с поглощением тепла, ибо, относя теплоты образования из элементов к граммовым частицам, обозначая поглощение его знаком минус и выражая количества его в больших калориях (Кал.), Бертело и Вейль («Sur la forée des matières explosives d’après la Thermochimie» par Berthelot, т. II, p. 256 et 260) нашли: для гремучей ртути (284 грам.) — 62,9 Кал., для азотнокислого диазобензола (167 грам.) — 47,4 Кал.
Таким образом, область взрывчатых веществ является довольно широкой. Их можно разделить на следующие группы:
- Группа I. Взрывчатые смеси, составленные из горючих и сжигающих веществ, самих по себе в отдельности не взрывчатых, а именно:
- 1-я подгруппа — газовые взрывчатые смеси.
- 2-я подгруппа — взрывчатые растворы.
- 3-я подгруппа — пороховые смеси (твердые), распределяющиеся, в свою очередь, по семействам соответственно натуре сжигающего деятеля.
- Группа II. Азотные эфиры:
- 1-я подгруппа — эфиры многоатомных алкоголей и их смеси. Относящиеся сюда нитроглицериновые препараты размещаются в семейства: а) динамиты с недеятельным основанием, б) динамиты с деятельным основанием, в) взрывчатые желатины.
- 2-я подгруппа — эфиры углеводов, из которых пироксилин с различными препаратами, его содержащими, образует отдельное семейство.
- Группа III. Нитросоединения: а) чистые (не смешанные с окислителями), напр. пикриновая кислота; б) смеси их с различными сжигающими деятелями, напр. пикриновые пороха, смеси нитроуглеводородов с NH4NO3 и др.
- Группа IV. Гремучие соли.
- Группа V. Взрывчатые диазосоединения.
- Группа VI. Взрывчатые вещества, не содержащие в себе углерода: NH4NO3, NCl3, NHJ2 и др.
Но далеко не все вещества, обладающие взрывчатостью, могут применяться в технике. Практика пользуется только такими из них, которых ценность сравнительно невелика, постоянство (неизменность) при хранении в разных климатах обеспечено, практическое получение не связано с затруднениями и опасностями. Столь же важны, кроме того, еще следующие условия: устойчивость при ударе, трении, сотрясении и тому подобных влияниях, могущих иметь место во время перевозки и употребления, способность взрывать, притом без отказа, только при определенном способе воспламенения и неуклонность в величине и характере взрывчатого действия. Пригодные для практического употребления В. вещества относятся главным образом к первым трем группам и отчасти к четвертой. В настоящее время преобладающее значение сосредоточивается особенно на порохе, нитроглицерине, динамитах и пироксилине (в различных его препаратах). Благодаря силе В. В. из нитроглицерина и пироксилина они вытесняют обыкновенный порох при производстве разнообразных взрывных работ. Порох продолжает еще держаться для производства метательных действий, но новейшие исследования, приведшие к открытию бездымного пороха, позволяют заключить, что и в этой области применений нитроглицерин и пироксилин в ближайшем будущем займут первенствующее место.
II. Разложение взрывчатых веществ
Состав и тепловые явления при образовании из элементов, определяя взрывчатые свойства, не дают еще полных основ для более точной характеристики В. веществ; для этого необходимо знать также состав и тепловые явления при образовании продуктов взрыва, другими словами — должны быть известны уравнения их разложения. Обыкновенно для возбуждения разложения В. вещество (или некоторая его доля) должно быть нагрето до определенной температуры, которая называется температурой его воспламенения, напр. обыкновенный порох — до 270°, пироксилин и нитроглицерин — до 180° и пр. В действительности, однако, такие температуры представляют величины изменчивые в зависимости от быстроты нагревания; вообще же говоря, это — такие температуры, при которых происходит химическое превращение В. веществ в газы, составляющее сущность взрывов. Согласно разнообразным исследованиям, сюда относящимся, В. вещества вообще способны разлагаться по различным уравнениям в зависимости от условий возбуждения разложения. Первым В. веществом, хорошо исследованным в указанном отношении, был обыкновенный (черный, дымный) порох. Образцовое исследование его начато было Бунзеном с Шишковым и завершено Абелем и Ноблем. Но так как это есть механическая смесь, то здесь дело очень сложно и изменчиво. Поучительнее определенные В. вещества. Типическим примером может служить азотно-аммиачная соль H 4NO3, которая, по Бертело, смотря по быстроте и степени нагревания, разлагается по крайней мере по 5 различным уравнениям, то с поглощением, то с большим или меньшим отделением тепла («An. de Chimie et de Phys.», 4-e série, t. XVIII, p. 68), а именно — считая все продукты разложения газообразными, а взятую соль твердой, относя теплоты разложения к граммовой частице (80 грам.) и обозначая выделение тепла (в отличие от поглощения) знаком плюс, могут иметь место следующие превращения:
| NH4NO3 | = HNO3 + NH3 …. | — 41,3 Кал. |
| " | = N2O + 2H2O …. | + 10,2 " |
| " | = 0,5N2 + NO + 2Н2О . | + 9,2 " |
| " | = 0,75N2 + 0,5NO2 + 2Н2О | + 29,5 " |
| " | = N2 + О2 + 2H2O … | + 30,7 " |
Первые три реакции происходят постепенно при осторожном нагревании соли до плавления и выше; из них преобладающая, по которой главным образом совершается разложение в этих условиях, есть вторая, то есть та, которая применяется в лабораториях для получения закиси азота. Пятое уравнение, а также отчасти и четвертое соответствуют взрывчатому разложению, имеющему место при быстром и сильном нагревании, напр. при бросании нескольких кристалликов соли в докрасна накаленную стеклянную трубку. Подобную способность к разнообразному разложению В. вещества проявляют особенно вследствие неодинаковости местных условий, получающихся в массе, подвергнутой прогрессивному нагреванию, напр. в парафиновой ванне. Эти условия могут быть: или химические, напр. неоднородность смешения, изменение вещества предварительным менее значительным нагреванием; или физические, напр. температура, охлаждающие влияния, конденсация, испарение; или, наконец, механические, напр. давление, сотрясение и т. п. Такая же неодинаковость местных условий получается и при воспламенении В. веществ с помощью обыкновенных способов (см. Запалы), под малыми давлениями. Но если взятое вещество химически однородно по всей массе, как, напр., нитроглицерин, пироксилин, гремучая ртуть, если оно каким-либо способом сразу подвергнуто одинаковым условиям наиболее сильного нагревания во всех своих частях, то взрыв его дает продукты простые, наиболее прочные, и все разложение легко выражается одним уравнением. Такая простота разложения взрывчатых химических соединений замечается или при воспламенении их в прочных бомбах под высокими давлениями, или при взрывании с помощью капсюля с гремучей ртутью, вызывающего своим взрывом однообразные частичные расположения и состояния заряда. Только уравнения подобных правильных разложений является возможным предвидеть в настоящее время благодаря исследованиям Бертело, Сарро и Вьейля («Mé moriales des poudres et salpêtres», t. I. et II). Но дадим сначала краткое описание употребленных ими приборов.
Для изучения разложений под давлениями, близкими к атмосферному, вещество (около 1 грамма) помещается в маленькую трубочку a b (см. рис. 1) около 50 мм длиной и 4 мм в диаметре, верхняя часть ее посредством каучуковой смычки е и стеклянной трубки f соединяется с бутылью, наполненной ртутью, а нижняя часть сообщается с каучуковым шаром C с помощью более широкой трубки AB (около 150 мм длиной), снабженной боковым каучуковым рукавом с зажимом D.
Поместив зажимы в е и D, производят накаливание проволоки током в нижней части заряда; очевидно, что тогда разложение совершится, благодаря эластичности каучукового шара, под давлением, близким к атмосферному. Образующиеся газы переводятся в сосуд со ртутью, выпуская последнюю из крана и под конец погружая открытый конец каучукового рукава в чашку с водой, для того чтобы вытеснить остаток газов. Анализ газов, в этих условиях получающихся, и привел к вышеуказанному заключению о разнообразии и сложности их состава. Вследствие местных охлаждений реакции не доходят до конца, и получаются продукты, способные еще к дальнейшему взаимодействию с отделением значительных количеств тепла. Так, для нитроглицерина (в динамите) найдены были CO 2, СО, Н 2, СН 4, N2 и NO; для пироксилина — СО2, СО, Н2, СН4, N2, NO; для смеси пироксилина с азотно-аммиачной солью в пропорции для полного горения — СО2, СО, Н2, N2, NO. Количества окиси азота во всех случаях получились большие, а следовательно, много кислорода действительно осталось не употребленным на горение.
Для исследования разложений под высокими давлениями служили бомбы, употребляемые для определения количеств отделяющегося при взрыве тепла (калориметрическая) и для измерения давлений газов (манометрическая). Получающаяся при взрыве вода остается в бомбе вместе с твердыми продуктами, откуда может быть извлечена в поглотительные приборы (трубки с хлористым кальцием) и в последних дозирована. Для этого стоит только, поставив бомбу в баню при 100°, пропускать в нее воздух, вводя его по трубке, вставленной в отверстие для запального приспособления и проводя далее в поглотительные приборы. Для выпускания газов в калориметрической бомбе имеется специальный кран В с очень тонкой винтовой нарезкой снаружи и каналом по оси; нижняя коническая часть его притерта к отверстию в крышке.
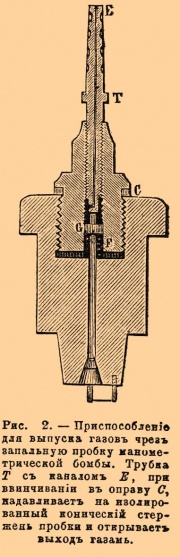
В манометрической бомбе выпускание газов делается с помощью особого приспособления Т, ввинчиваемого в пробку бомбы, служащую для воспламенения заряда (см. рис. 2); поворачивая стержень с каналом Е, производят нажатие на изолированный конус, который удерживается от падения посредством пружины F и гайки G так, что кругом конуса можно образовать по произволу большее или меньшее отверстие. Из бомб газы переводились в ртутный газометр емкостью около 10 литров, специально для этой цели устроенный (см. рис. 3).
Он состоит из чугунной ртутной ванны А с кольцеобразным сечением, в которую погружается стеклянный колокол В, служащий собственно для собирания газов. Этот колокол двигается внутри другого стеклянного колокола C с водой, укрепленного неподвижно и снабженного вверху воронкой D. Объем газов, введенных под колокол В, измеряется количеством воды, вытекающей из боковой трубки воронки D. Движение внутреннего колокола направляется посредством скрепленного с ним железного стержня ЕЕ', с помощью которого по произволу можно то нажимать, то приподнимать внутренний колокол и тем самым изменять давление газов. Для поднятия служит винт F в железной раме GG, расположение которой со всеми частями понятно само собой из рисунка. Введение газов производится через кран Н и каучуковую трубку I. Перед началом операции выкачиванием воздуха через Т доводят ртуть до манометра M и наполняют внешний колокол водой, пока она не начнет выливаться из D. При взрыве в прочных бомбах, как показали анализы газов, собранных описанным способом, уже не получается ни окиси азота (по крайней мере в значительном количестве), ни горючих газов при достаточном количестве кислорода, то есть горение бывает более полным.
Для изучения продуктов взрыва, получающихся при специальном способе возбуждения разложения с помощью капсюля с гремучей ртутью, употреблялась манометрическая бомба большой емкости (320 вместо 22 куб. сант.). В центре ее подвешивался цилиндрик прессованного пироксилина в 32 гр. с капсюлем, содержащим 0,6 гр. гремучей ртути, так, чтобы заряд не касался стенок. При этом состав продуктов оказался почти тот же, как при возбуждении разложения накаленным телом при соответствующих условиях заряжания.
Обращаясь к выводам, заметим, что они, говоря вообще, оправдали правило Бертело ("Mé canique chimique, par Berthelot, t. II, p. 467), по которому при воспламенении данного взрывчатого вещества сначала стремятся происходить разом, смотря по местным условиям, всякие реакции, возможные между присутствующими элементами без содействия внешней энергии, и притом каждая реакция со своей собственной скоростью. В конце некоторого короткого промежутка времени получится смесь различных соединений, относительные пропорции которых будут зависеть в особенности от этих скоростей. Если получающиеся соединения не способны реагировать друг на друга вследствие быстрого охлаждения, то все они и остаются существовать в общей смеси продуктов взрыва. Если же означенные соединения будут находиться в тесном прикосновении между собой при возвышенной температуре достаточное время, то они вступят между собой в такое взаимодействие, что окончательно получится система тел прочных, отвечающих наибольшему отделению тепла. Полученные при ближайшем изучении предмета результаты действительно подтверждают это правило: несмотря на разнообразие разложений в зависимости от местных условий, в них замечается стремление к образованию той системы продуктов, которая, будучи прочной, в то же время отделяет наибольшее количество тепла. а) Если вещество содержит в себе достаточное количество кислорода для полного сжигания горючих элементов, то получаются исключительно прочные продукты полного окисления, азот же выделяется в свободном состоянии. Так, разложение нитроглицерина точно отвечает уравнению: 2С3Н5(NO3)3 = 6CO2 + 5Н2 О + 3N2 + 0,5О2. То же самое имеет место для нитроманнита С6 Н8 (NО3)6 и др. подобных соединений. Правило прилагается и к взрывчатым смесям, напр. к смеси пироксилина и азотно-аммиачной соли: C12H14O4(NO3)6 + 10NH4NO3 = 12CO2 + 27H2O + 13N2 + 0,5O2. Но такому именно способу разложения всех этих веществ отвечает и наибольшее количество отделяющегося тепла; при всякой другой комбинации элементов его отделилось бы меньше. Незначительные уклонения замечаются только для смесей, содержащих в себе KNO3, без сомнения — вследствие неоднородности состояния системы продуктов взрыва. б) Если же во взятом веществе содержится недостаточное количество кислорода, то ход разложения, вообще говоря, усложняется и состав продуктов изменяется отчасти с возрастанием плотности их или давления. Здесь представляются следующие случаи: случай 1-й — эндотермическое соединение содержит избыток горючих элементов, напр. гремучая ртуть, азотнокислый диазобензол. Разложение их таково: HgC2N2O2 = 2CO + N2 + Hg и 2C6H5N2NO3 = 6СО + 6С + 5Н2 + 3N2, то есть реакции идут в сторону образования окиси углерода. Получающиеся системы тел хотя могли бы дать место дальнейшему химическому взаимодействию с отделением тепла, напр. 2СО = СО2 + С или 2СО + 2Н 2 = СО2 + СН4, но, с одной стороны, эти последние реакции требуют более значительного времени, а после взрыва тотчас следует охлаждение, с другой — СО2 при возвышенной температуре есть тело непрочное, подвергающееся диссоциации с образованием СО и О, а свободный кислород тотчас окисляет накаленный уголь в СО, другими словами — система 2СО сравнительно с системой СО2 + С есть прочнейшая. Кроме того, в приведенных уравнениях пренебрежено малыми количествами побочных продуктов; так, в 100 объемах продуктов взрыва гремучей ртути содержится 0,15 об. СО2. Количество этих не вошедших в уравнение продуктов (СH4, NH3, HCN и других соединений С с H и N) для азотнокислого диазобензола достигает 9 %, что обусловливается главн. обр. влиянием водорода. Случай 2-й — количество кислорода, оставаясь недостаточным, будет больше, чем сколько нужно для превращения всего углерода в СО, и вещество представляет собой экзотермическое соединение. Сюда относятся, например, пироксилин, пикриновая кислота и многие другие В. вещества. Продукты взрыва пироксилина при малых плотностях газов состоят из СО2, Н2О, СО, Н2 и N2, и с возрастанием плотности наблюдается только увеличение пропорции углекислоты вследствие реакции Н2О + СО = СО2 + Н2, идущей с отделением около +10 Кал.; когда же с дальнейшим возрастанием плотности газообразная смесь на счет этой реакции сильно обогатится водородом, начинает замечаться, кроме того, появление в незначительном количестве болотного газа вследствие реакции 2СО + 2Н2 = СО2 + СН4, происходящей с отделением около +61 Кал., то есть в рассматриваемом случае избыток кислорода, остающийся после превращения всего углерода в СО, распределяется между этим газом и водородом, с возрастанием плотности отходя все более и более к первому из них благодаря двум указанным побочным реакциям. Пренебрегая образованием болотного газа и выражая состав пироксилина формулой, придаваемой ему Вьейлем («Соmр. rend.», t. XCV, p. 132), C24H29O9(NO3)11, разложения его могут быть выражены следующими уравнениями:
| С24Н29О9(NO3)11 | |
| Плотность газов | |
| 0,023 | 15СО + 9CO2 + 9H2O + 5,5H2 + 5,5N2 |
| 0,300 | 13СО + 11CO2 + 7Н2О + 7,5Н2 + 5,5N2 |
| 1,000 | 12СО + 12СО2 + 6Н2О + 8,5Н2 + 5,5N2 |
Для пикриновой кислоты, содержащей еще менее кислорода, реакции, уменьшающие пропорцию СО, проявляются резче, так что образованием болотного газа здесь уже нельзя пренебречь:
| 8C6H2(NO2)3OH | |
| Плотность газов | |
| 0,100 | 5,5СО2 + 42СО + 12N2 + 0,5CH4 + 8Н2 + 3Н2О |
| 0,500 | 12,5СО2 + 30,5СО + 12N2 + 4,75СН4 +2Н2 + 0,5Н2О + 0,25С |
то есть между данными пределами плотности, в то время как только 2,5 частицы СО превратились в СО2 на счет водяного пара, 9 частиц ее исчезли вследствие реакции с водородом. То же самое имеет место и при взрывах неполных азотных эфиров клетчатки, напр. так называемого коллодионного хлопка C24H32O12(NO3)8, отличающегося от обыкновенного пироксилина способностью растворяться в смеси спирта с эфиром и по содержанию кислорода ближе подходящего к пикриновой кислоте.
Хотя таким образом приведенные исследования и подтверждают правило Бертело, однако на основании его можно с точностью предвидеть уравнения разложения только для веществ, богатых кислородом, притом в условиях, наиболее благоприятных для полного окончания реакций. Если же пропорция кислорода недостаточна, то по мере уменьшения ее простые продукты окисления, вступая между собой и с водородом в дальнейшее взаимодействие, более и более дают начало новым продуктам, и тогда распределение кислорода между окисью углерода и водородом, равно как количество болотного газа, без непосредственного анализа является доныне не предусматриваемым.
Еще большую сложность представляют разложения таких смесей, содержащих недостаточное количество кислорода, как обыкновенный порох, так как, что бы ни делали, механическое смешение трех порошкообразных тел никогда не может достигнуть однородности настоящих химических соединений, и следовательно, осуществление одинаковости местных условий горения уже по этой одной причине здесь недостижимо. Отсылая для более близкого изучения разложения обыкновенного пороха к специальным сочинениям (напр. «Traité sur la poudre etc.», par Upmann et Meyer, traduite par Desortiaux), заметим здесь только, что согласно наиболее полному и обширному исследованию Нобля и Абеля состав продуктов взрыва почти не допускает выражения их каким-либо простым химическим уравнением. Главных продуктов, однако, только шесть — три газообразных СО2, СО, N2, три твердых K2SO4, K2CO3, K2S, и если взять средние количества их, выведенные из частных анализов, всегда более или менее отличающихся между собой, то разложение артиллерийского сорта пороха, по Дебусу, может быть представлено уравнением: 8KNO3 + 3,5S + 10,5C = 6,5CO2 + 1,5СО + 4 N2 + 2,5K2СО3 + 0,5K2SO4 + K2S3. Бертело, имея в виду те же главные продукты взрыва и выражая состав артиллерийского пороха несколько отличающейся от предыдущей формулой 2KNO3 + S + 3С, считает более вероятным рассматривать всякий случай разложения его как результат комбинации по два, по три и т. д. следующих 5 основных простых реакций, происходящих в различных точках массы:
- (1) 2KNO3 + S + 3С = K2S + 3СО2 + N2,
- (2) 2KNO3 + 3С = К2СО3 + СО2 + СО + N2,
- (3) 2KNO3 + 2,5С = К2СО3 + 1,5СО2 + N2,
- (4) 2KNO3 + S + 2С = K2SO4 + 2СО + N2,
- (5) 2KNO3 + S + С = K3SO4 + СО2 + N2.
К подобному же заключению привели исследования Н. П. Федорова. Но, какова бы ни была суть дела, факт сложности и колебаний разложения смесей, подобных обыкновенному пороху, остается в полной своей силе, и, несомненно, главная причина его заключается в неоднородности смешения.
Указанные выводы относятся к продуктам, получающимся после охлаждения, но, спрашивается, одинаковы ли они с теми, которые существуют при максимуме температуры, развивающейся во время взрыва? С одной стороны, можно полагать, что некоторые из окончательных продуктов образуются во время охлаждения; так, по предположению Малляра и Ле Шателье, первичные продукты суть всегда продукты прямого горения, то есть СО2, СО, H2O, H2, N2; такие же газы, как СH4, происходят вследствие вторичных реакций («Mé moriales des poudres et salpêtres», t. II). С другой стороны, несомненно, что СО 2 и H 2 O при возвышенной температуре подвергаются так наз. диссоциации (см. это сл.). Из этих двух причин, могущих определить рассматриваемое нетождество продуктов взрыва, наибольшее значение имеет последняя. Бунзен («An. de Chimie et de Phys.», 4-e série, t. XIV, p. 446), исследуя гремучие смеси СО + O, Н2 +О в 1868, пришел к заключению, что при максимуме температуры, развивающейся при взрыве, только 1/3 их находится в виде окончательных продуктов горения (Н2О и СО2), остальные же 2/3 остаются несоединенными и вступают в соединение лишь по мере охлаждения. Но позднейшие теоретические и экспериментальные исследования показали, что закон природы «действие равно противодействию» (см. Взаимодействие сил) управляет всеми химическими равновесиями и в том числе явлениями диссоциации. Ле Шателье, рассматривая влияние давления на диссоциацию СО2, Н2 О и других подобных тел, заключает, что при весьма больших давлениях диссоциация должна быть ничтожно мала, так как СО + О и Н2 + О превращаются в СО2 и H2 O с сокращением объема при постоянном давлении или с уменьшением давления в постоянном объеме, а по означенному закону — всякий раз, когда мы подобную систему, находящуюся в состоянии диссоциации, подвергаем увеличенному давлению, в ней непременно возбуждается процесс, стремящийся понизить давление, то есть наступает частное соединение остававшихся несоединенными частей, влекущее за собой повышение пропорции окончательных продуктов. Впоследствии Ле Шателье («Zeitschr. für Phys. u. Chemie», t. 2, s. 782) нашел из опытов кривую, показывающую, как падает постепенно коэффициент диссоциации СО 2 с увеличением давления и стремится к нулю при весьма высоких давлениях. Следовательно, на изменение состава окончательных продуктов при температурах взрыва диссоциация не может оказать заметного влияния вследствие именно громадных давлений, развиваемых взрывчатыми веществами в замкнутых пространствах или при очень быстром сгорании.
Большая или меньшая простота и правильность разложения имеет существенное значение для практических применений В. веществ, так как уравнением его определяется величина механического действия. Если реакции сложны и неопределенны, то от различия и случайности их должны проистекать различие и случайность механических действий. А так как взрывчатые химические соединения разлагаются с гораздо большей простотой и правильностью, чем взрывчатые смеси (порох), то там, где требуется правильность механического действия, им, очевидно, как более доступным управлению, сообразно различным целям практики должно быть отдано предпочтение перед взрывчатыми смесями. Говоря словами Бертело, при употреблении для стрельбы все преимущество грубой смеси, называемой обыкновенным порохом, перешедшей к нам по традиции от прошлых веков, состоит в том, что она развивает свою силу постепенно, но это касается уже другой стороны предмета — скорости разложения, и известным образом возможно умерить эту скорость и для взрывчатых химических соединений.
III. Скорость разложения взрывчатых веществ
При изучении этой стороны предмета нужно различать скорость собственно реакций, происходящих в веществе, все части которого подвержены одинаковым условиям температуры, давления и др., от скорости распространения этих реакций в массе, части которой находятся в различных условиях. На практике обыкновенно приходится иметь дело с той и другой скоростью одновременно вследствие принятых способов возбуждения реакций в одной какой-либо точке заряда. Пусть разложение возбуждено с помощью накаленного тела или огня: воспроизведение условий, определяющих разложение от слоя к слою, может совершаться, вообще говоря, с различной скоростью в зависимости от окружающего давления, природы взрывчатого вещества, свойств оболочки и т. п. Наблюдая горение одного большого зерна или нескольких малых зерен обыкновенного пороха, мы замечаем сначала весьма быстрое распространение пламени по поверхности их (воспламенение) и затем более медленное проникновение пламени внутрь — сгорание концентрическими слоями. Если из пороховой смеси приготовить призмы (от 0,5 до 2,5 килогр. весом) с боками, намазанными салом, и расположить их вертикально, то при зажжении верхнего основания происходит горизонтальными слоями горение, скорость которого легко измерить. Пиобер, производя такие опыты на открытом воздухе, нашел, что под обыкновенным давлением для французского артиллерийского пороха она равна от 10 до 13 мм в секунду. Подобным же образом можно изучать скорость горения и под увеличенными давлениями. Отто с этой целью впрессовывал пороховую смесь в трубку с дном, другой конец которой был открыт; изменение давления достигалось изменением количества впрессованного состава. Можно также при исследовании влияния очень больших давлений пользоваться данными о временах пробегания снарядами канала орудий, производя стрельбу изменчивыми количествами пороха и допуская, что заряды сгорают совершенно при вылете снарядов из дула; этим способом Костан нашел, что скорость горения артиллерийского пороха под средним давлением, получающимся в пушках большого калибра, около 320 мм в секунду. С понижением давления скорость горения, наоборот, быстро уменьшается. Так, по опытам Франкланда, произведенным в трубках, в которых постоянное давление во время горения поддерживалось выкачиванием газов с помощью насоса при давлении 722 мм, время сгорания заряда длиной в 152 мм равнялось 30,3 сек., а при давлении 405 мм оно было 45,5 секунд. Такие же результаты получил Сен-Робер при опытах на различных высотах Альп. Когда при понижении давлений дойдем наконец до пустоты, то скорость горения пороха падает настолько, что оно в этих условиях обнаруживается лишь медленным тлением (опыты Бойля, Гюйгенса и др.). Вообще, большая или меньшая скорость горения есть результат большей или меньшей быстроты, с которой нагретые газы удаляются от соседних порций несгоревшего вещества, другими словами — давление определяет число нагретых газообразных частиц, которые в каждое мгновение приходят в прикосновение с не воспламененными еще твердыми частицами. Так как число происходящих при этом ударов на поверхность взрывчатого вещества пропорционально давлению газов, то обозначая через v 0 и v скорости горения под атмосферным давлением р 0 и давлением р, можно написать: v/v 0 = (p/p0)a, где α должно быть определено из опыта. Результаты измерений показывают, что этот показатель для давлений, меньших 1 атмосферы, равен 0,66, а для значительно больших — величину его можно принять 0,5. Если бы горение происходило в постоянном объеме, то, каково бы ни было давление, начальная температура нагретых газовых частиц была бы чувствительно одна и та же. Но при горении под постоянным давлением, как в вышеизложенных опытах, газы производят внешнюю работу, причем температура их непременно понижается, притом под различными давлениями неодинаково. Кроме того, при производстве опытов неизбежно бывает охлаждение вследствие теплопроводности и лучеиспускания. Поэтому под различными давлениями будет изменяться не только число частиц пороха, нагреваемых в единицу времени при ударах газовых частиц, но и температура нагревания, а именно: при малых давлениях вследствие более благоприятных условий охлаждения эта температура будет ниже, чем при высоких давлениях. Но изучение скоростей химических реакций вообще показывает, что с возрастанием температуры они увеличиваются с гораздо большей быстротой, чем температура; а следовательно, изменение скорости горения с давлением должно быть также результатом и большей или меньшей скорости самих реакций. Другие взрывчатые вещества не были столь подробно исследованы; однако отношения, замеченные для пороха, в большей или меньшей мере повторяются и для них. По наблюдениям Абеля («Liebig’s Jahresb.» 1864, s. 801), горение пироксилина в пустоте происходит столь медленно, что заметно лишь в темноте по являющемуся зеленоватому свету; под давлением около 25 мм замечается небольшое желтоватое пламя, а при давлениях начиная от 76 мм и более пламя делается блестящим. Окружающий разреженный газ при этом не остается без влияния: в то время, как воздух, азот, углекислота, окись углерода, водород, болотный газ не различаются чувствительно по своему действию, чистый кислород повышает напряженность горения, то есть для одинакового приблизительно замедления горения он требует большого разрежения, что объясняется отделением добавочного количества тепла вследствие дальнейшего горения продуктов разложения на счет кислорода и, следовательно, большим нагреванием соседних порций пироксилина. Подобным образом происходит в пустоте и горение нитроглицерина. Гремучая ртуть, наоборот, в пустоте от соприкосновения с накаленной проволокой взрывает, но взрыв не передается соседним не прикасающимся порциям, которые только разбрасываются. Под обыкновенным атмосферным давлением, по Пиоберу, скорость горения пироксилина, взятого в виде рыхлой массы, в 8 раз больше, чем обыкновенного пороха; в прессованном же состоянии (в виде шашек или цилиндров, полученных из предварительно измельченной массы), по опытам Абеля, он сгорает медленнее, подобно обыкн. пороху. В таком изменении скорости горения в зависимости от консистенции вещества — изменении, наблюдаемом и у других взрывчатых веществ, прежде всего играет роль диффузия накаленных газов, которые легко проникают в рыхлую массу и ограничиваются только поверхностным слоем в прессованной. Кроме того, при этом важное значение имеет и теплопроводность. Волокна самого пироксилина обладают значительной теплопроводностью; воздух же, содержащийся между волокнами, представляет плохой проводник тепла. Очевидно, в прессованной массе, содержащей в своих порах сравнительно очень мало воздуха, теплота будет распространяться с большей легкостью по всему заряду, а следовательно, части, окружающие точку воспламенения, только в весьма незначительном слое успеют нагреться до температуры разложения. Насколько теплопроводность в самом деле влияет на быстроту горения, это может быть показано посредством следующего простого опыта: скрутив рыхлый пироксилин в нить, помещают последнюю на железный брусок и прикасаются к концу ее накаленным телом; нить тогда тлеет, так как тепло, отделяемое в каждой горящей точке, быстро отнимается железом, представляющим хороший проводник тепла. С другой стороны, скорость горения и прессованного пироксилина можно сильно увеличить, если перед зажиганием нагреем его до температуры несколько ниже точки взрывчатого разложения, напр. до 150°: тогда отвлечение тепла от точки воспламенения ослабится, одновременно будет нагреваться до точки взрыва большая часть окружающей массы, и последняя, будучи уже нагрета предварительно, скорее достигнет этой точки. Подобно прессованному пироксилину, сгорают на открытом воздухе также нитроглицерин (в динамитах) и взрывчатые смеси, содержащие в себе нитросоединения. Из последних — заключающие в себе азотно-аммиачную соль вследствие большой теплоемкости как ее самой, так и образующейся при ее разложении воды вступают в горение только после предварительного нагревания выше 100°, при обыкновенной же температуре, начав гореть, скоро тухнут или даже совсем не загораются. Гремучая ртуть при воспламенении на открытом воздухе дает место настоящему взрыву, сходному с производимым другими веществами только в более или менее прочных оболочках. То же наблюдается с хлористым и йодистым азотом.
Указанные разности в скорости горения В. веществ на открытом воздухе относятся, однако, только к малым зарядам и определяются не только их химическим составом, физическими свойствами, консистенцией, но и сопротивлением окружающего воздуха. Вследствие того, что скорость разложения при передаче его от слоя к слою быстро растет с температурой и количество вещества, одновременно разлагающегося, увеличивается по мере распространения горения, при очень больших зарядах получатся иные отношения. Так, взятые в больших количествах прессованный пироксилин и нитроглицерин, начав гореть спокойно, окончательно так же взрываются на открытом воздухе, как и гремучая ртуть: по мере хода горения температура и с ней скорость разложения слоев постепенно повышаются; газы, вначале свободно преодолевавшие сопротивление атмосферы, испытывая все большее и большее затруднение в передвижении, образуют как бы более и более прочную оболочку для позднее сгорающих слоев, вследствие чего последние будут разлагаться под увеличенным давлением, пока наконец ядро массы не сгорит с наибольшей возможной скоростью. Таков именно механизм явлений, происходящих при пожарах в складах этих веществ, оканчивающихся обыкновенно всегда ужасными взрывами. Гремучая ртуть и вещества, ей подобные, тем только и отличаются главным образом, что способны взрываться на воздухе даже при зажигании малых количеств, то есть достигать сразу огромных скоростей разложения, при которых окружающие частицы воздуха не успевают уступить нарастающим давлениям и оттого представляют сопротивление расширению газов, сходное с сопротивлением более прочной оболочки.
С малыми зарядами большие скорости горения наблюдаются при воспламенении В. веществ лишь в прочных оболочках. Относящиеся сюда данные были добыты преимущественно Сарро и Вьейлем попутно при изучении давлений. Определяя промежутки времени, в течение которых происходило сжатие медных цилиндриков в крёшере (см. далее VIII), приспособленном к бомбе, из этих промежутков находилось время нарастания давлений до максимума, очевидно, соответствующее быстроте сгорания заряда. Для измерения означенных промежутков времени (см. рис. 4) бомба В, закрепленная в зажиме М, снабжалась крёшером С, так устроенным, что при опытах поршень его посредством прикрепленного легкого пера р мог чертить закон своего движения в течение сжатия цилиндрика на поверхности цилиндра К, вращающегося с известной скоростью.
Этот цилиндр покрывается закопченной бумагой и приводится в движение или с помощью электромотора, или посредством падающего груза; скорость вращения его определяется камертоном, снабженным пером, чертящим на бумаге в момент воспламенения синусоиду S, волнам которой соответствует точно определенное предварительно время. До взрыва перо р чертит на цилиндре окружность а, при взрыве — кривую ab и по окончании взрыва, когда прекратилось сжатие цилиндрика, — окружность b. Расстояние между этими двумя окружностями, считаемое по производящей цилиндра К, равно полному сжатию цилиндрика крёшера. Расстояние между производящими, проведенными через а и b, деленное на скорость движения окружности цилиндра, равно времени сжатия цилиндрика крёшера. Из этих найденных описанным способом времен θ получены были следующие продолжительности горения τ (см. VIII) трех важнейших взрывчатых веществ:
Примечания
- ↑ [О применении взрывчатых веществ, кроме статей о пушках, ружьях, минах и т. п. военных приспособлениях, в «Энциклопедическом словаре» говорится в статьях: Взрывные работы (туннелей и т. п.), Газовые двигатели, Горное дело, Соль, Запалы, Патроны и друг. Нельзя не упомянуть о том, что с 1891 г. взрывчатые вещества обещают получить на основании американских опытов новое приложение — для вызова дождя. Предмет этот доныне еще вовсе не обследован, писать о нем еще нельзя ни в утвердительном, ни в отрицательном смысле; но не существует, по мнению моему, никакой невозможности в вызове дождя при помощи взрывов, произведенных на некоторой высоте в атмосфере, потому что взрывы производят волны сгущения и разрежения, причем в поясе разрежения могут получаться из влаги воздуха дождевые осадки и происходить такие смешения слоев воздуха, имеющих различную температуру и относительную влажность, что достигается точка росы и, следовательно, наступают известные условия для образования дождевого осаждения. Известно, что в сухом сосуде (напр. графине), содержащем обыкновенный влажный воздух, при быстром разрежении воздуха (напр. ртом, плотно прижав губы) происходит туман и что громовые тучи часто выливают такое количество воды, которое, несомненно, не могло содержаться в туче, а происходит от сжижения влаги, находящейся в воздухе и близкой к точке росы, то есть туча несет условия дождеобразования, а не саму массу выливающейся воды, как проследил, напр., Мон в грозах Норвегии (см. «Метеорология» Мона). Нельзя также отрицать возможности происхождения электрической энергии при взрывах и участия этой энергии в образовании дождя. Соображения этого рода допускают возможность вызова взрывами дождя при известном сочетании благоприятных условий, но предмет этот, как и все явления дoждeoбpaзoвaния, еще требует многих научных работ, направленных в сторону покорения действующих здесь сил природы на службу человечеству. Если В. вещества помогут в этой победе, как помогают они уже ныне преодолевать твердыню горных хребтов, то они, как сталь уже ныне, в будущем послужат на такую пользу, что искупят ту массу зла, которая совершалась не раз при посредстве В. веществ. Предлагаемая читателям «Энциклопедического словаря» статья проф. Ив. Мих. Чельцова покажет, что научное знание взрывчатых веществ подвинулось за последнее время весьма значительно вперед, а это дает полную уверенность в том, что полезные применения В. веществ станут возрастать на службу достижения возможного общего мирного благополучия. — Д. Менделеев.]
- В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.